题目内容
10.雾霾天气严重影响人们的生活健康,治理污染是化学工作者义不容辞的职责,因而对SO2、NOx等进行研究其有重要意义.请根据以下信息回答有关问题:
I.NOx是汽车尾气的主要污染物之一.
(1)汽车发动机工作时会引发N2和O2反应,其能量变化示意图如下:
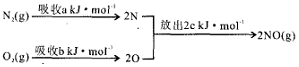
该反应的△H=+(a+b-2c)kJ/mol.
(2)科学家通过实验发现,在紫外线照射下TiO2会使空气中的某些分子产生活性基团OH,并且活性基团OH可与NO2、NO发生反应生成硝酸和水.根据图1示,请写出OH与NO反应的化学方程式NO+3OH=HNO3+H2O.
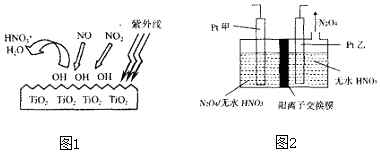
(3)电解法可将工业废气中含有的NO2消除.原理是先将NO2转化为N2O4,然后电解得到N2O5(常温下为无色固体,常做绿色硝化剂).电解原理如图2所示,该电解池中生成N2O5的电极反应式是N2O4+2HNO3-2e-=2N2O5+2H+.
Ⅱ.工业上采取多种措施减少SO2的排放.
(4)碘循环工艺具体流程如图:
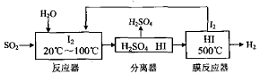
①用化学方程式表示反应器中发生的反应SO2+I2+2H2O=H2SO4+2HI.
②在HI分解反应中使用膜反应器分离出H2的目的是HI的分解为可逆反应,分离出产物H2,有利于反应正向进行.
③该工艺流程的优点有既能吸收SO3降低污染,又能制得氢气和硫酸,反应器中生成的可以循环使用.
(5)喷雾干燥法脱硫是除去SO2的常见方法,先将含SO2的废气溶于水,再用饱和石灰浆吸收,吸收液中c(Ca2+ )一直保持为0.70mol/L,则吸收液中的c(SO42-)为2.0×10-7mol/L.[已知该温度下,Ksp (CaSO3)=1.4×10-7].
分析 (1)反应热=吸收的能量-放出的能量,根据能量变化图计算反应热,再根据热化学反应方程式的书写规则书写;
(2)图象可知NO、NO2均被OH氧化为HNO3,依据原子守恒得到;
(3)由N2O4制取N2O5需要是去电子,所以N2O5在阳极区生成;
(4)①从流程图可知,在反应器中,I2氧化SO2,生成硫酸和HI;
②HI分解是可逆反应,分离出氢气有利于平衡正向移动;
③流程分析可知污染气体被吸收制备得到氢气和硫酸,反应过程中物质也可以循环使用;
(5)根据硫酸钙的溶度积常数表达式Ksp(CaSO3)=c(Ca2+)•c(SO32-)进行计算.
解答 解:(1)根据图示可知,该反应的反应热=(a+b)kJ/mol-2×ckJ/mol,所以该热化学反应方程式为:N2(g)+O2(g)=2NO(g)△H=+(a+b-2c)kJ/mol,
故答案为:+(a+b-2c)kJ/mol;
(2)由图象可知NO、NO2均被OH氧化为HNO3,依据原子守恒得到,NO+3OH═HNO3+H2O,
故答案为:3OH+NO═HNO3+H2O;
(3)从电解原理来看,N2O4制备N2O5为氧化反应,则N2O5应在阳极区生成,Pt(甲)为阳极,电极反应式为:N2O4+2HNO3-2e-=2N2O5+2H+,
故答案为:N2O4+2HNO3-2e-=2N2O5+2H+;
(4)①从流程图可知,在反应器中,I2氧化SO2,生成硫酸和HI,反应方程式为:SO2+I2+2H2O=H2SO4+2HI,
故答案为:SO2+I2+2H2O=H2SO4+2HI;
②HI分解为可逆反应,及时分离出产物H2,有利于反应正向进行,
故答案为:HI分解为可逆反应,及时分离出产物H2,有利于反应正向进行.
③该工艺流程的优点有:既能吸收SO3降低污染,又能制得氢气和硫酸,反应器中生成的可以循环使用,
故答案为:既能吸收SO3降低污染,又能制得氢气和硫酸,反应器中生成的可以循环使用;
(5)根据硫酸钙的溶度积常数表达式Ksp(CaSO3)=c(Ca2+)•c(SO32-)可知,c(SO32-)=$\frac{Ksp(CaS{O}_{3})}{c(C{a}^{2+})}$=$\frac{1.4×1{0}^{-7}}{0.7}$mol/L=2.0×10-7mol/L,c(SO32-)=c(SO42-)=2.0×10-7mol/L,
故答案为:2.0×10-7mol/L.
点评 本题考查了热化学方程式焓变计算、电解原理分析和电极反应书写、化学平衡影响因素、Ksp相关计算等,掌握基础是关键,题目难度中等.


| A. | 1 mol阿司匹林最多可消耗2 mol NaOH | |
| B. | 阿司匹林的分子式为C9H10O4 | |
| C. | 水杨酸可以发生取代、加成、氧化、加聚反应 | |
| D. | 服用阿司匹林,身体出现水杨酸不良反应时,可静脉注射NaHCO3溶液 |
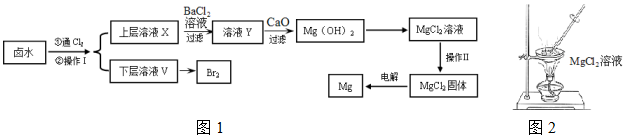
(1)操作Ⅰ的名称是萃取分液,所用主要玻璃仪器的名称是分液漏斗、烧杯;需要选择的试剂是c(填序号).
a.乙醇 b.苯 c.四氯化碳 d.裂化汽油
(2)通氯气反应的离子方程式Cl2+2Br-=2Cl-+Br2.
(3)证明SO42-完全沉淀的方法是静置向上层清液中继续加入BaCl2溶液,若不产生白色沉淀则证明SO42-已沉淀完全.
(4)CaO用来调节溶液Y的pH,可以使Mg2+沉淀完全,由表中数据可知,理论上应控制pH范围是11.0<pH<12.2.
| 开始沉淀时 | 沉淀完全时 | |
| Mg2+ | pH=9.6 | pH=11.0 |
| Ca2+ | pH=12.2 | c(OH-)=1.8mol/L |
(6)工业上用惰性电极电解熔融状态下的氯化镁来冶炼镁,不能直接电解氯化镁溶液的原因是Mg2++2H2O+2Cl-$\frac{\underline{\;通电\;}}{\;}$Mg(OH)2↓+H2↑+Cl2↑(用离子方程式表示).
(7)在探究Mg(OH)2溶解性的实验中,发现向装有少量Mg(OH)2浊液的试管中加入适量NH4Cl晶体,充分振荡后浊液会变澄清,请用化学平衡的原理解释浊液变澄清的原因Mg(OH)2(s)?Mg2+(aq)+2OH-(aq),NH4Cl电离出的NH4+与OH?结合成弱电解质一水合氨,降低了c(OH-),Mg(OH)2溶解平衡向右移动.
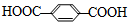 +nHOCH2CH2OH$\stackrel{一定条件}{→}$涤纶+(2n-1)H2O下列说法正确的是( )
+nHOCH2CH2OH$\stackrel{一定条件}{→}$涤纶+(2n-1)H2O下列说法正确的是( )| A. | 合成涤纶的反应为加聚反应 | |
| B. | 对苯二甲酸和苯甲酸互为同系物 | |
| C. | 1 mol涤纶与NaOH溶液反应,理论上最多可消耗2n mol NaOH | |
| D. | 涤纶的结构简式为: |
| A. | H2O2的电子式: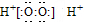 | |
| B. | 氮原子最外层电子轨道表达式: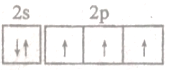 | |
| C. | Cl中子数为18的氯原子结构示意图: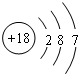 | |
| D. | 碳酸氢钠的电离方程式:NaHCO3?Na++H++CO32- |
| A. | 钠与CuSO4溶液反应:2Na+Cu2+═Cu+2Na+ | |
| B. | 稀H2SO4和Ba(OH)2溶液反应:H++SO42-+Ba2++OH-═BaSO4+H2O | |
| C. | 少量SO2通入苯酚钠溶液中:C6H5O-+SO2+H2O═2C6H5OH+SO32- | |
| D. | 醋酸钠的水解反应:CH3COO-+H3O+═CH3COOH+H2O |




 亚硫酸钠在存放过程中会因为被氧化而变质,某研究性学习小组的同学对一种亚硫酸钠样品是否变质及变质程度进行了探究.
亚硫酸钠在存放过程中会因为被氧化而变质,某研究性学习小组的同学对一种亚硫酸钠样品是否变质及变质程度进行了探究.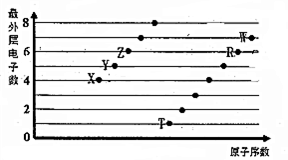 部分短周期元素原子最外层电子数与原子序数的关系如图,回答下列问题:
部分短周期元素原子最外层电子数与原子序数的关系如图,回答下列问题: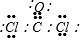 ;已知1mol XZW2与4mol NaOH
;已知1mol XZW2与4mol NaOH