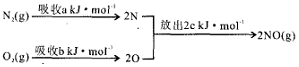
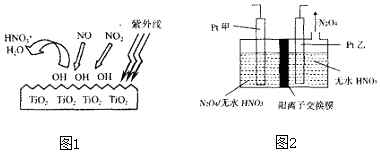
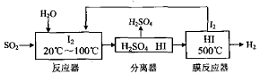
题目内容
19.下列有关化学用语的表示正确的是( )| A. | H2O2的电子式: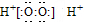 | |
| B. | 氮原子最外层电子轨道表达式: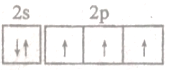 | |
| C. | Cl中子数为18的氯原子结构示意图: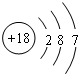 | |
| D. | 碳酸氢钠的电离方程式:NaHCO3?Na++H++CO32- |
分析 A.H2O2为共价化合物;
B.氮原子最外层有5个电子,分别位于2s、2p轨道;
C.Cl的核电荷数为17;
D.碳酸氢钠电离出钠离子和碳酸氢根离子.
解答 解:A.H2O2为共价化合物,电子式为 ,故A错误;
,故A错误;
B.氮原子最外层有5个电子,分别位于2s、2p轨道,则最外层电子轨道表达式为 ,故B正确;
,故B正确;
C.Cl的核电荷数为17,原子结构示意图为 ,故C错误;
,故C错误;
D.碳酸氢钠电离出钠离子和碳酸氢根离子,电离方程式为NaHCO3?Na++HCO3-,故D错误.
故选B.
点评 本题考查了常见化学用语的表示方法,为高频考点,题目难度不大,涉及电子式、原子结构示意图、电离方程式等知识,明确常见化学用语的书写原则为解答关键,试题培养了学生的规范答题能力.

练习册系列答案
相关题目
9.NA表示阿佛加德罗常数的值,下列关于0.2mol/LK2SO4溶液的说法正确的是( )
| A. | 500mL溶液中所含K+、SO42-总数为0.3NA | |
| B. | 500mL溶液中含有0.1NA个K+ | |
| C. | 1L溶液中K+浓度为0.2 mol/L | |
| D. | 1L溶液中SO42-的浓度为0.4 mol/L |
7.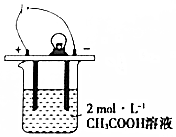 如图所示,烧杯中的溶液为2mol•L-1CH3COOH溶液,接通直流电源,分别向烧杯中加入下列物质(保持反应温度不变),灯泡变暗的是( )
如图所示,烧杯中的溶液为2mol•L-1CH3COOH溶液,接通直流电源,分别向烧杯中加入下列物质(保持反应温度不变),灯泡变暗的是( )
 如图所示,烧杯中的溶液为2mol•L-1CH3COOH溶液,接通直流电源,分别向烧杯中加入下列物质(保持反应温度不变),灯泡变暗的是( )
如图所示,烧杯中的溶液为2mol•L-1CH3COOH溶液,接通直流电源,分别向烧杯中加入下列物质(保持反应温度不变),灯泡变暗的是( )| A. | 加入固体NaOH | B. | 加水稀释 | C. | 加入金属Na | D. | 通入HC1气体 |
14.下列有机物的同分异构体数目最多的( )
| A. | C5H12 | B. | 甲苯的二氯代物 | C. | C6H14 | D. | C5H12O(醇类结构) |
2. 硫酸是工业生产中最为重要的产品之一,在化学工业的很多领域都要用到浓硫酸.
硫酸是工业生产中最为重要的产品之一,在化学工业的很多领域都要用到浓硫酸.
(1)在硫酸工业生产中,我国采用黄铁矿为原料生产SO2,反应的化学方程式为:4FeS2+11O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+8SO2,该反应在沸腾炉(填设备名称)中进行.
(2)有关接触法制硫酸的下列说法中,正确的是C.
A.二氧化硫的接触氧化在合成塔中发生
B.吸收塔得到的是98.3%的浓硫酸
C.煅烧含硫48%的黄铁矿时,若FeS2损失了2%,则S损失2%
D.接触室中采取高温是为了提高催化剂的活性和提高SO2的转化率
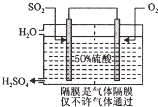
(3)科研工作者开发了制备SO2,再用电化学原理生产硫酸的方法,装置如图:为了稳定技术生产,硫酸的浓度应维持不变,则通人的SO2和水的质量比为16﹕29.
(4)实验测得SO2反应生成SO3的转化率与温度、压强有关,请根据下表信息,结合工业生产实际,选择最合适的生产条件是400℃.1个标准大气压.
(5)硫酸工厂排放的尾气中,含少量二氧化硫.为防止污染大气,在排放前必须进行尾气处理并设法进行综合利用.硫酸工厂排放尾气中的SO2通常用足量石灰水吸收,然后再用稀硫酸处理.
①请写出这种尾气处理方法的优点(写出两点即可):原料生石灰、硫酸价格便宜且容易获得;可得到石膏副产品;产生的SO2含量较高可再利用作为原料
②若某硫酸厂每天排放的1万立方米(标准状况)尾气中含0.2%(体积分数)的SO2,通过上述方法处理,理论上需生石灰50kg.
 硫酸是工业生产中最为重要的产品之一,在化学工业的很多领域都要用到浓硫酸.
硫酸是工业生产中最为重要的产品之一,在化学工业的很多领域都要用到浓硫酸.(1)在硫酸工业生产中,我国采用黄铁矿为原料生产SO2,反应的化学方程式为:4FeS2+11O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+8SO2,该反应在沸腾炉(填设备名称)中进行.
(2)有关接触法制硫酸的下列说法中,正确的是C.
A.二氧化硫的接触氧化在合成塔中发生
B.吸收塔得到的是98.3%的浓硫酸
C.煅烧含硫48%的黄铁矿时,若FeS2损失了2%,则S损失2%
D.接触室中采取高温是为了提高催化剂的活性和提高SO2的转化率
(3)科研工作者开发了制备SO2,再用电化学原理生产硫酸的方法,装置如图:为了稳定技术生产,硫酸的浓度应维持不变,则通人的SO2和水的质量比为16﹕29.
(4)实验测得SO2反应生成SO3的转化率与温度、压强有关,请根据下表信息,结合工业生产实际,选择最合适的生产条件是400℃.1个标准大气压.
| 压强 SO2转化率 温度 | 1个大气压 | 5个大气压 | 10个大气压 | 15个大气压 |
| 400℃ | 0.9961 | 0.9972 | 0.9984 | 0.9988 |
| 500℃ | 0.9675 | 0.9767 | 0.9852 | 0.9894 |
| 600℃ | 0.8520 | 0.8897 | 0.9276 | 0.9468 |
①请写出这种尾气处理方法的优点(写出两点即可):原料生石灰、硫酸价格便宜且容易获得;可得到石膏副产品;产生的SO2含量较高可再利用作为原料
②若某硫酸厂每天排放的1万立方米(标准状况)尾气中含0.2%(体积分数)的SO2,通过上述方法处理,理论上需生石灰50kg.
9.下列叙述正确的是( )
| A. | 钢铁吸氧腐蚀过程中正极反应为2H++2e-═H2↑ | |
| B. | 惰性电极电解熔融NaCl时阴极、阳极产生气体体积比为1:1 | |
| C. | H2在反应Li2NH+H2═LiNH2+LiH中既是氧化剂又是还原剂 | |
| D. | 用铁做电极电解CuCl2溶液的离子方程式为Cu2++2Cl-$\frac{\underline{\;电解\;}}{\;}$Cu+Cl2↑ |
7.现有六种元素,其中B、C、D、E为短周期主族元素,F、G为第四周期元素,它们的原子序数依次增大.请根据下列相关信息,回答问题
(1)B基态原子的电子排布式为1s22s22p3;F基态原子的价电子排布式为3d54s1;G基态原子的最外层电子排布图为 .
.
(2)C和与其左右相邻元素原子的第一电离能由大到小的顺序是Mg>Al>Na(用元素符号填空).
(3)B、D的电负性相对大小:B大于D(用“大于”、“小于”或“等于”填空).
(4)以上六种元素中,位于s区的有1种,位于p区的有4种.
(5)DE3的电子式为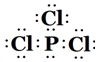 .
.
| B元素原子的核外p电子数比s电子数少1 |
| C原子的第一至第四电离能分别是:I1=738kJ/mol I2=1451kJ/mol I3=7733kJ/mol I4=10540kJ/mol |
| D原子核外所有p轨道全满或半满 |
| E元素的主族序数与周期数的相差4 |
| F 是前四周期原子电子排布图中单电子数最多的元素 |
| G在周期表的第十一列 |
 .
.(2)C和与其左右相邻元素原子的第一电离能由大到小的顺序是Mg>Al>Na(用元素符号填空).
(3)B、D的电负性相对大小:B大于D(用“大于”、“小于”或“等于”填空).
(4)以上六种元素中,位于s区的有1种,位于p区的有4种.
(5)DE3的电子式为
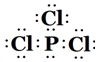 .
.