题目内容
2.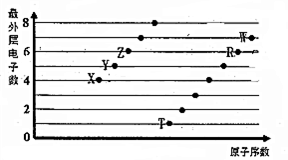 部分短周期元素原子最外层电子数与原子序数的关系如图,回答下列问题:
部分短周期元素原子最外层电子数与原子序数的关系如图,回答下列问题:(1)Z在周期表中的位置第二周期Ⅵ族.
(2)图中字母表示的6种元素,原子半径最大的是Na(写元素符号);
(3)6种元素任意组合,写出漂白原理不同的任意两种物质的化学式SO2、NaClO(或ClO2).
(4)以下说法正确的是C
A.元素非金属性:R>W B.最高价氧化物对应水化物的酸性:X>Y
C.与Z形成化合物的种类:X<Y D.简单离子半径:W>R
(5)某种有毒气体,分子组成为XZW2,这种有毒气体的电子式是
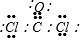 ;已知1mol XZW2与4mol NaOH
;已知1mol XZW2与4mol NaOH溶液反应生产两种正盐以及水,写出此反应的化学反应方程式COCl2+4NaOH=2NaCl+Na2CO3+2H2O;生成物溶液中各离子浓度由大到小的顺序是c(Na+)>c(Cl-)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+).
分析 都是短周期元素,Z、R最外层都含有6个电子,则Z为O、S元素;X最外层含有4个电子,为C元素;Y最外层含有5个电子,为N元素;T只能位于第三周期,最外层含有1个电子,为Na元素;W最外层含有7个电子,位于第三周期,为Cl元素,据此进行解答.
解答 解:都是短周期元素,Z、R最外层都含有6个电子,则Z为O、R为S元素;X最外层含有4个电子,为C元素;Y最外层含有5个电子,为N元素;T只能位于第三周期,最外层含有1个电子,为Na元素;W最外层含有7个电子,位于第三周期,为Cl元素,
(1)Z为O元素,原子序数为8,位于周期表中第二周期Ⅵ族,
故答案为:第二周期Ⅵ族;
(2)原子电子层越多,原子半径越大,电子层相同时核电荷数越大,原子半径越小,则6种元素中原子半径最大的为Na元素,
故答案为:Na;
(3)6种元素任意组合,可以形成具有漂白性的物质物质有:SO2、NaClO、ClO2等,其中NaClO、ClO2的漂白原理相同,都利用强氧化性,而SO2的漂白原理是与有色物质形成无色物质,
故答案为:SO2;NaClO(或ClO2);
的任意两种物质的化学式
(4)A.R为S、W为Cl元素,二者位于同一周期,原子序数越大,非金属性越强,则元素非金属性:R<W,故A错误;
B.X、Y分别为C、N元素,非金属性越强,最高价氧化物对应水化物的酸性越强,非金属性N>C,则最高价含氧酸酸性:X<Y,故B错误;
C.X、Y分别为C、N元素、Z为O,C与O形成的化合物有一氧化碳、二氧化氮,而N与O元素形成的化合物有NO、N2O、NO2、N2O4等,则形成化合物的种类:X<Y,故C正确;
D.R为S、W为Cl元素,对应离子分别为硫离子、氯离子,两种离子的电子层相同,核电荷数越大离子半径越小,则简单离子半径:W<R,故D错误;
故选C.
(5)XZW2为COCl2,COCl2分子的中心原子为C,其分子中含有1个碳氧双键、2个碳氯键,其结构式为: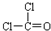 ,则其电子式为
,则其电子式为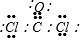 ;
;
1molCOCl2与与4mol NaOH溶液反应生产两种正盐以及水,生成的正盐应该为NaCl和碳酸钠,该反应的化学方程式为:COCl2+4NaOH=2NaCl+Na2CO3+2H2O;
反应后溶质为2molNaCl、1molNa2CO3,c(Na+)最大,c(Cl-)其次,CO32-发生水解生成HCO3-和OH-,还来自水的电离则c(OH-)>c(HCO3-),溶液中离子浓度大小为:c(Na+)>c(Cl-)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+),
故答案为: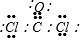 ;COCl2+4NaOH=2NaCl+Na2CO3+2H2O;c(Na+)>c(Cl-)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+).
;COCl2+4NaOH=2NaCl+Na2CO3+2H2O;c(Na+)>c(Cl-)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+).
点评 本题考查原子结构与元素周期律的综合应用,题目浓度较大,推断元素为解答关键,注意熟练掌握原子结构与元素周期律、元素周期表的关系,试题知识点较多、综合性较强,充分考查了学生的分析、理解能力及灵活应用能力.

| 选项 | 实验 | 现象 | 结论 |
| A | 向KBrO2溶液中加入少量苯,然后通入少量Cl2 | 有机层呈橙色 | 氧化性:Cl2>KBrO2 |
| B | 向KNO3和KOH混合溶液中加入铝粉并加热,将湿润的红色石蕊试纸放在试管口 | 试纸变为蓝色 | NO${\;}_{3}^{-}$被还原为NH3 |
| C | 向0.1mol•L-1的Na2CO3溶液中加入两滴酚酞,溶液显浅红色,微热 | 红色加深 | 盐类水解是吸热反应 |
| D | 将0.1mol•L-1的MgSO4溶液滴入到NaOH溶液中至不再有沉淀产生,再滴加0.1mol•L-1的CuSO4溶液 | 白色沉淀逐渐变为蓝色沉淀 | Ksp[Cu(OH)2]<Ksp[Mg(OH)2] |
| A. | A | B. | B | C. | C | D. | D |
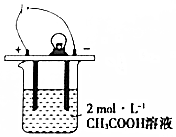 如图所示,烧杯中的溶液为2mol•L-1CH3COOH溶液,接通直流电源,分别向烧杯中加入下列物质(保持反应温度不变),灯泡变暗的是( )
如图所示,烧杯中的溶液为2mol•L-1CH3COOH溶液,接通直流电源,分别向烧杯中加入下列物质(保持反应温度不变),灯泡变暗的是( )| A. | 加入固体NaOH | B. | 加水稀释 | C. | 加入金属Na | D. | 通入HC1气体 |
| A. | C5H12 | B. | 甲苯的二氯代物 | C. | C6H14 | D. | C5H12O(醇类结构) |
| A. | 钢铁吸氧腐蚀过程中正极反应为2H++2e-═H2↑ | |
| B. | 惰性电极电解熔融NaCl时阴极、阳极产生气体体积比为1:1 | |
| C. | H2在反应Li2NH+H2═LiNH2+LiH中既是氧化剂又是还原剂 | |
| D. | 用铁做电极电解CuCl2溶液的离子方程式为Cu2++2Cl-$\frac{\underline{\;电解\;}}{\;}$Cu+Cl2↑ |
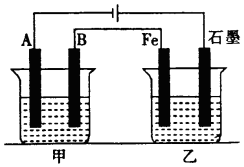 如图所示,甲、乙为相互串联的两电解池,甲池利用电解原理在铁上镀银,一段时间后,甲池阴极增重43.2g,乙中盛放足量的CuSO4溶液,请回答(1)~(3)小题:
如图所示,甲、乙为相互串联的两电解池,甲池利用电解原理在铁上镀银,一段时间后,甲池阴极增重43.2g,乙中盛放足量的CuSO4溶液,请回答(1)~(3)小题: