题目内容
18.下列离子方程式书写正确的是( )| A. | 钠与CuSO4溶液反应:2Na+Cu2+═Cu+2Na+ | |
| B. | 稀H2SO4和Ba(OH)2溶液反应:H++SO42-+Ba2++OH-═BaSO4+H2O | |
| C. | 少量SO2通入苯酚钠溶液中:C6H5O-+SO2+H2O═2C6H5OH+SO32- | |
| D. | 醋酸钠的水解反应:CH3COO-+H3O+═CH3COOH+H2O |
分析 A.钠与硫酸铜溶液反应不会生成铜单质;
B.氢离子、氢氧根离子的计量数错误;
C.亚硫酸氢根离子的酸性大于苯酚,二者反应生成苯酚和亚硫酸钠;
D.醋酸根离子水解生成醋酸和氢氧根离子,该反应不是水解反应.
解答 解:A.钠与CuSO4溶液反应生成硫酸钠、氢气和氢氧化铜沉淀,正确的离子方程式为:2Na+2H2O+Cu2+═H2↑+2Na++Cu(OH)2↓,故A错误;
B.稀H2SO4和Ba(OH)2溶液反应生成硫酸钡沉淀和水,正确的离子方程式为:2H++SO42-+Ba2++2OH-═BaSO4+2H2O,故B错误;
C.少量SO2通入苯酚钠溶液中,反应生成苯酚和亚硫酸钠,反应的离子方程式为:C6H5O-+SO2+H2O═2C6H5OH+SO32-,故C正确;
D.醋酸钠的水解反应生成醋酸和氢氧化钠,正确的水解反应为:CH3COO-+H2O?CH3COOH+OH-,故D错误;
故选C.
点评 本题考查了离子方程式的判断,题目难度不大,注意掌握离子方程式的书写原则,明确离子方程式正误判断常用方法:检查反应能否发生,检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合原化学方程式等.

练习册系列答案
 名牌学校分层周周测系列答案
名牌学校分层周周测系列答案 黄冈海淀全程培优测试卷系列答案
黄冈海淀全程培优测试卷系列答案
相关题目
9.下列叙述正确的是( )
| A. | 钢铁吸氧腐蚀过程中正极反应为2H++2e-═H2↑ | |
| B. | 惰性电极电解熔融NaCl时阴极、阳极产生气体体积比为1:1 | |
| C. | H2在反应Li2NH+H2═LiNH2+LiH中既是氧化剂又是还原剂 | |
| D. | 用铁做电极电解CuCl2溶液的离子方程式为Cu2++2Cl-$\frac{\underline{\;电解\;}}{\;}$Cu+Cl2↑ |
3.下列方案中,依照相应实验药品及图示装置进行实验,能达到相应实验目的是( )
| 方案 | Ⅰ | Ⅱ | Ⅲ | Ⅳ |  |
| ① | 浓硝酸 | Na2S | AgCl溶液 | NaOH溶液 | |
| ② | 浓醋酸 | CaCO3 | NaOH溶液(过量) | Na2SiO3溶液 | |
| ③ | 浓盐酸 | KMnO4 | NaBr溶液 | KI溶液 | |
| ④ | 浓硫酸 | 蔗糖 | KMnO4溶液(过量) | 石灰水 |
| A. | 用①来验证溶解度:S(Ag2S)<S(AgCl) | |
| B. | 用②来验证酸性:CH3COOH>H2CO3>H2SiO3 | |
| C. | 用③来验证氧化性:KMnO4>Cl2>Br2>I2 | |
| D. | 用④来验证蔗糖与浓硫酸作用后有SO2和CO2产生 |
7.现有六种元素,其中B、C、D、E为短周期主族元素,F、G为第四周期元素,它们的原子序数依次增大.请根据下列相关信息,回答问题
(1)B基态原子的电子排布式为1s22s22p3;F基态原子的价电子排布式为3d54s1;G基态原子的最外层电子排布图为 .
.
(2)C和与其左右相邻元素原子的第一电离能由大到小的顺序是Mg>Al>Na(用元素符号填空).
(3)B、D的电负性相对大小:B大于D(用“大于”、“小于”或“等于”填空).
(4)以上六种元素中,位于s区的有1种,位于p区的有4种.
(5)DE3的电子式为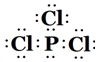 .
.
| B元素原子的核外p电子数比s电子数少1 |
| C原子的第一至第四电离能分别是:I1=738kJ/mol I2=1451kJ/mol I3=7733kJ/mol I4=10540kJ/mol |
| D原子核外所有p轨道全满或半满 |
| E元素的主族序数与周期数的相差4 |
| F 是前四周期原子电子排布图中单电子数最多的元素 |
| G在周期表的第十一列 |
 .
.(2)C和与其左右相邻元素原子的第一电离能由大到小的顺序是Mg>Al>Na(用元素符号填空).
(3)B、D的电负性相对大小:B大于D(用“大于”、“小于”或“等于”填空).
(4)以上六种元素中,位于s区的有1种,位于p区的有4种.
(5)DE3的电子式为
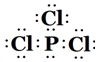 .
. 
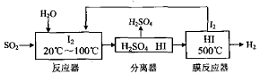
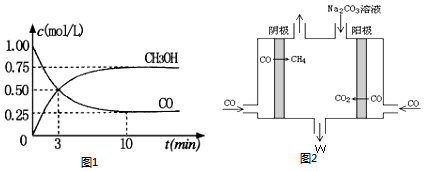
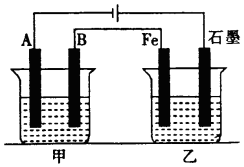 如图所示,甲、乙为相互串联的两电解池,甲池利用电解原理在铁上镀银,一段时间后,甲池阴极增重43.2g,乙中盛放足量的CuSO4溶液,请回答(1)~(3)小题:
如图所示,甲、乙为相互串联的两电解池,甲池利用电解原理在铁上镀银,一段时间后,甲池阴极增重43.2g,乙中盛放足量的CuSO4溶液,请回答(1)~(3)小题: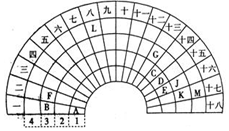 元素周期表的形式多种多样,如图是扇形元素周期表的一部分(前四周期的元素),对比中学常见元素周期表,回答下列问题:
元素周期表的形式多种多样,如图是扇形元素周期表的一部分(前四周期的元素),对比中学常见元素周期表,回答下列问题: .
. .
.