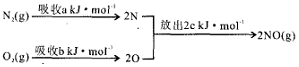
题目内容
15. 亚硫酸钠在存放过程中会因为被氧化而变质,某研究性学习小组的同学对一种亚硫酸钠样品是否变质及变质程度进行了探究.
亚硫酸钠在存放过程中会因为被氧化而变质,某研究性学习小组的同学对一种亚硫酸钠样品是否变质及变质程度进行了探究.I.是否变质的探究
(l)实验中他们首先取10.0g样品,并将其准确地配制成500mL溶液,则配制过程中肯定需要用到的度量仪器有烧杯、托盘天平、500mL容量瓶.
(2)甲同学取所配溶液适量分别放在A、B两支试管中,向A中依次加入足量盐酸、BaCl2溶液,根据所产生的现象表明样品已变质;向B中加入溴水,由溴水褪色(填现象)并结合A中现象知样品已部分变质,B中反应的离子方程式为SO32-+H2O+Br2=2H++SO42-+2Br-.
Ⅱ.样品中亚硫酸钠百分含量的测定
(l)气化法
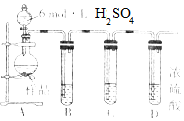
乙同学欲利用如图所示的装置,测量生成SO2的质量.
①装置B、C中的试剂分别是浓硫酸、氢氧化钠溶液.
②与其他测量方法相比,此种测量方法量出Na2SO3的百分含量总是偏低的,其原因是由于SO2可溶于水且最后会有一部分SO2残留在烧瓶与B试管的液面上(写出一条).
(2)滴定法
丙同学准确量取25.00mL所配溶液放入锥形瓶中,用o.l mol•L-1的酸性KMnO4溶液进行滴定.
①使用碱式滴定管取用Na2SO3溶液,滴定终点时的现象是滴入最后一滴高锰酸钾溶液时,溶液由无色编号为浅红色且半分钟内无变化.
②若滴定终点时消耗a mL标准溶液,则样品中Na2SO3的质量分数为6.3a%.
(3)新方案的设计
请你设计一种新的方案,以测量出样品中Na2SO3的百分含量取一定量样品与足量盐酸酸化的BaCl2溶液反应,过滤、洗涤、干燥生成的BaSO4质量的方法,测量样品中Na2SO3的质量分数(答出测量原理即可).
分析 Ⅰ.称量样品时需要使用托盘天平,配制溶液时需要使用500ml容量瓶、烧杯,确定Na2SO3已变质,就是检验样品中有SO42-生成,故相应的试剂依次是盐酸、BaCl2溶液,当Na2SO3部分变质时,样品中还有SO32-,溴单质氧化亚硫酸根离子生成硫酸根,故样品可使溴水褪色;
Ⅱ.(1)①由于是测量生成的SO2的质量,故C中应该用碱溶液做吸收剂,B中应该是浓硫酸用来干燥SO2;
②由于SO2可溶于水且最后会有一部分SO2残留在烧瓶与B试管的液面上,故导致测量出的Na2SO3百分含量偏低;
(2)①亚硫酸钠溶液中亚硫酸根离子水解溶液显碱性,盛放在碱式滴定管,用高锰酸钾溶液滴定氧化亚硫酸根离子,用高锰酸钾溶液颜色判断反应终点;
②由得失电子守恒关系5n(Na2SO3)=2n(KMnO4),故25.00ml溶液中含n(Na2SO3)=2.5a×10-4mol,由此可求出Na2SO3的质量分数;
(3)还可以通过测量出一定量样品与足量酸反应生成的SO2体积或者与足量盐酸酸化的BaCl2溶液反应生成的BaSO4质量的方法测量样品中Na2SO3的质量分数;
解答 解:Ⅰ.(1)实验中他们首先取10.0g样品,并将其准确地配制成500mL溶液,则配制过程中肯定需要用到的度量仪器有称量样品时需要使用托盘天平,配制溶液时需要使用500mL容量瓶、烧杯,
故答案为:托盘天平、500mL容量瓶;
(2)确定Na2SO3已变质,就是检验样品中有SO42-生成,甲同学取所配溶液适量分别放在A、B两支试管中,故相应的试剂依次是盐酸、BaCl2溶液,当Na2SO3部分变质时,样品中还有SO32-,溴单质氧化亚硫酸根离子生成硫酸根,故样品可使溴水褪色,反应的离子方程式为:SO32-+H2O+Br2=2H++SO42-+2Br-,
故答案为:BaCl2溶液;溴水褪色;SO32-+H2O+Br2=2H++SO42-+2Br-;
Ⅱ.(1)①由于是测量生成的SO2的质量,故C中应该用碱溶液做吸收剂,B中应该是浓硫酸用来干燥SO2,装置B、C中的试剂分别是浓硫酸、氢氧化钠溶液,
故答案为:浓硫酸、氢氧化钠溶液;
②与其他测量方法相比,此种测量方法量出Na2SO3的百分含量总是偏低的,是由于SO2可溶于水且最后会有一部分SO2残留在烧瓶与B试管的液面上,故导致测量出的Na2SO3百分含量偏低,
故答案为:由于SO2可溶于水且最后会有一部分SO2残留在烧瓶与B试管的液面上;
(2)①亚硫酸钠溶液中亚硫酸根离子水解溶液显碱性,盛放在碱式滴定管,滴定终点时的现象是:由于SO2可溶于水且最后会有一部分SO2残留在烧瓶与B试管的液面上,
故答案为:碱;由于SO2可溶于水且最后会有一部分SO2残留在烧瓶与B试管的液面上;
②由得失电子守恒关系5n(Na2SO3)=2n(KMnO4),故25.00ml溶液中含n(Na2SO3)=2.5a×10-4mol,由此可求出Na2SO3的质量分数=$\frac{2.5a×1{0}^{-4}×126×\frac{500}{25}g}{10.0g}$×100%=6.3a%,
故答案为:6.3a%;
(3)还可以通过测量出一定量样品与足量酸反应生成的SO2体积或者与足量盐酸酸化的BaCl2溶液反应生成的BaSO4质量的方法测量样品中Na2SO3的质量分数,取一定量样品与足量盐酸酸化的BaCl2溶液反应,过滤、洗涤、干燥生成的BaSO4质量的方法,测量样品中Na2SO3的质量分数,
故答案为:取一定量样品与足量盐酸酸化的BaCl2溶液反应,过滤、洗涤、干燥生成的BaSO4质量的方法,测量样品中Na2SO3的质量分数.
点评 本题考查了物质组成、物质性质、物质特征反应现象等实验设计、实验过程的理解应用,注意实验误差分析和实验基本操作和定量计算,掌握基础是解题关键,题目难度中等.

 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案| 选项 | 实验 | 现象 | 结论 |
| A | 向FeSO4溶液中先滴入KSCN 溶液再滴加H2O2溶液 | 加入H2O2后溶液变成血红色 | Fe2+既有氧化性又有还原性 |
| B | 常温下将铜片放入浓硫酸中 | 生成刺激性气味的气体 | 反应生成了SO2 |
| C | 室温下,向浓度均为0.1mol•L-1的BaC12和CaCl2混合溶液中滴加Na2SO4溶液 | 出现白色沉淀 | Ksp(BaSO4)<Ksp(CaSO4) |
| D | 向Ba(NO3)2溶液中通入SO2气体 | 有白色沉淀生成 | 沉淀是BaSO4 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 肯定不含I- | B. | 可能不含Cu2+ | C. | 可能含有SO32- | D. | 以上结论都不对 |
| A. | 保存NaClO溶液时加入少量NaOH可以抑制水解 | |
| B. | pH<4时,起漂白作用的Cl2是HClO分解产生的 | |
| C. | 随pH降低,溶液中HClO和Cl2增多,所以漂白速率加快 | |
| D. | 用NaClO溶液漂白色素时,不同条件下由不同成分起到漂白作用 |
| A. | 稀醋酸中加入少量醋酸钠能增大醋酸的电离程度 | |
| B. | 25℃时,等体积等浓度的硝酸与氨水混合后,溶液pH=7 | |
| C. | 50℃时,NH4Cl和HCl的混合液中:c(NH4+)+c(H+)=c(OH-)+c(Cl-) | |
| D. | 0.1molAgCl和0.1molAgI混合后加入1L水中,所得溶液中c(Cl-)=c(I-) |
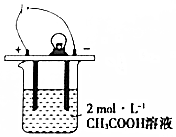 如图所示,烧杯中的溶液为2mol•L-1CH3COOH溶液,接通直流电源,分别向烧杯中加入下列物质(保持反应温度不变),灯泡变暗的是( )
如图所示,烧杯中的溶液为2mol•L-1CH3COOH溶液,接通直流电源,分别向烧杯中加入下列物质(保持反应温度不变),灯泡变暗的是( )| A. | 加入固体NaOH | B. | 加水稀释 | C. | 加入金属Na | D. | 通入HC1气体 |
 硫酸是工业生产中最为重要的产品之一,在化学工业的很多领域都要用到浓硫酸.
硫酸是工业生产中最为重要的产品之一,在化学工业的很多领域都要用到浓硫酸.(1)在硫酸工业生产中,我国采用黄铁矿为原料生产SO2,反应的化学方程式为:4FeS2+11O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+8SO2,该反应在沸腾炉(填设备名称)中进行.
(2)有关接触法制硫酸的下列说法中,正确的是C.
A.二氧化硫的接触氧化在合成塔中发生
B.吸收塔得到的是98.3%的浓硫酸
C.煅烧含硫48%的黄铁矿时,若FeS2损失了2%,则S损失2%
D.接触室中采取高温是为了提高催化剂的活性和提高SO2的转化率
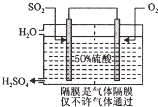
(3)科研工作者开发了制备SO2,再用电化学原理生产硫酸的方法,装置如图:为了稳定技术生产,硫酸的浓度应维持不变,则通人的SO2和水的质量比为16﹕29.
(4)实验测得SO2反应生成SO3的转化率与温度、压强有关,请根据下表信息,结合工业生产实际,选择最合适的生产条件是400℃.1个标准大气压.
| 压强 SO2转化率 温度 | 1个大气压 | 5个大气压 | 10个大气压 | 15个大气压 |
| 400℃ | 0.9961 | 0.9972 | 0.9984 | 0.9988 |
| 500℃ | 0.9675 | 0.9767 | 0.9852 | 0.9894 |
| 600℃ | 0.8520 | 0.8897 | 0.9276 | 0.9468 |
①请写出这种尾气处理方法的优点(写出两点即可):原料生石灰、硫酸价格便宜且容易获得;可得到石膏副产品;产生的SO2含量较高可再利用作为原料
②若某硫酸厂每天排放的1万立方米(标准状况)尾气中含0.2%(体积分数)的SO2,通过上述方法处理,理论上需生石灰50kg.
| 方案 | Ⅰ | Ⅱ | Ⅲ | Ⅳ |  |
| ① | 浓硝酸 | Na2S | AgCl溶液 | NaOH溶液 | |
| ② | 浓醋酸 | CaCO3 | NaOH溶液(过量) | Na2SiO3溶液 | |
| ③ | 浓盐酸 | KMnO4 | NaBr溶液 | KI溶液 | |
| ④ | 浓硫酸 | 蔗糖 | KMnO4溶液(过量) | 石灰水 |
| A. | 用①来验证溶解度:S(Ag2S)<S(AgCl) | |
| B. | 用②来验证酸性:CH3COOH>H2CO3>H2SiO3 | |
| C. | 用③来验证氧化性:KMnO4>Cl2>Br2>I2 | |
| D. | 用④来验证蔗糖与浓硫酸作用后有SO2和CO2产生 |