题目内容
5.下列有关物质的组成、性质、用途的说法.正确的是( )①Na2O2中的阳离子和阴离子个数比为1:1
②常温下铝制容器可储运浓硫酸或浓硝酸
③盐酸既有氧化性又有还原性
④NO2,Fe(OH)3,FeC12都能直接通过化合反应制备
⑤H2S能使酸性高锰酸钾溶液褪色.所以它具有漂白性.
| A. | ②③④ | B. | ①②③ | C. | ①②③④ | D. | ①②③⑤ |
分析 ①根据Na2O2的电子式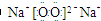 判断;
判断;
②常温下铝与浓硫酸或浓硝酸发生钝化;
③盐酸中氢离子具有氧化性,氯离子具有还原性;
④NO2可与NO和氧气反应生成,Fe(OH)3由氢氧化亚铁、氧气、水反应生成,FeC12可由氯化铁和铁反应生成;
⑤H2S具有还原性.
解答 解:①Na2O2的电子式为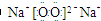 ,故阴、阳离子的个数比为1:2,故错误;
,故阴、阳离子的个数比为1:2,故错误;
②常温下铝与浓硫酸或浓硝酸发生钝化,在表面生成一层致密的氧化物膜,可起到保护作用,故正确;
③盐酸中氢离子具有氧化性,氯离子具有还原性,故正确;
④NO2可与NO和氧气反应生成,Fe(OH)3由氢氧化亚铁、氧气、水反应生成,FeC12可由氯化铁和铁反应生成,故正确;
⑤H2S具有还原性,可与酸性高锰酸钾发生氧化还原反应,故错误.
故选A.
点评 本题考查元素化合物知识,为高考高频考点,侧重于学生的分析能基础知识的综合运用,注意把握物质的性质以及应用,难度不大.

练习册系列答案
相关题目
15.下列关于胶体和溶液的说法中,正确的是( )
| A. | 胶体和溶液具有相同的性质:均一、稳定,静置后不产生沉淀 | |
| B. | 布朗运动是胶体粒子特有的运动方式,可以据此把胶体与溶液、悬浊液区分 | |
| C. | 可以利用丁达尔效应区分胶体和溶液 | |
| D. | 只有胶状的物质如胶水、果冻类的才能称为胶体 |
16.设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 密闭容器中2molNO与1molO2充分反应后,容器内气体的分子数为2NA | |
| B. | 用惰性电极电解CuSO4溶液后,如果加入0.1molCu(OH)2能使溶液复原,则电路中转移电子的数目为0.2NA | |
| C. | 142 g Na2SO4和Na2HPO4固体混合物中,阴阳离子总数为3NA | |
| D. | 过氧化钠与水反应时,生成0.1mol氧气转移的电子数为0.4NA |
13.下列物质直接参与的过程与氧化还原反应有关的是( )
| A. | 用乙醚从黄花蒿中提取青蒿素 | |
| B. | 用浸有酸性高锰酸钾的硅藻土作水果保鲜剂 | |
| C. | 生石灰用作煤炭燃烧的固硫剂 | |
| D. | 服用阿司匹林出现水杨酸反应时用小苏打解毒 |
20.0.5mol某羧酸与足量乙醇发生酯化反应,生成酯的质量比原羧酸的质量增加了28g,则原羧酸可能是( )
| A. | 甲酸 | B. | 乙二酸 | C. | 丙酸 | D. | 丁酸 |
17.用NA表示阿伏伽德罗常数的值.下列叙述不正确的是( )
| A. | 含4molSi-O键的二氧化硅晶体中氧原子数为2NA | |
| B. | 标准状况下,含3NA个σ键的甲醛分子所占的体积约为22.4L | |
| C. | 2molNO和1molO2混合,在密闭容器中充分反应,容器内的分子数小于2NA | |
| D. | 1molFe与一定量的硝酸反应,转移的电子数为0.2NA~0.3NA |
 ,B的结构简式为OGC-CHO.
,B的结构简式为OGC-CHO.
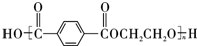 .
.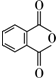 .
.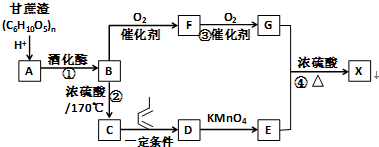
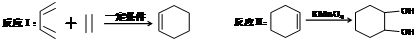
 ,F官能团的名称为醛基,
,F官能团的名称为醛基,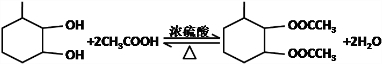 .
. Ⅰ.含六元环Ⅱ.能使溴的四氯化碳溶液褪色
Ⅰ.含六元环Ⅱ.能使溴的四氯化碳溶液褪色 的合成路线为
的合成路线为 .
.