题目内容
20.0.5mol某羧酸与足量乙醇发生酯化反应,生成酯的质量比原羧酸的质量增加了28g,则原羧酸可能是( )| A. | 甲酸 | B. | 乙二酸 | C. | 丙酸 | D. | 丁酸 |
分析 羧酸与足量乙醇反应的机理,醇脱氢酸脱羟基,所以酯化后得到的酯为RCOOC2H5分子组成上比原羧酸多了C2H4,假设酸是一元酸,那么可以算得1mol酸充分酯化反应之后增重应为28g,0.5mol某羧酸与足量乙醇发生酯化反应,生成酯的质量比原羧酸的质量增加了28g,因此不是一元酸,而是二元酸,由此分析解答.
解答 解:羧酸与足量乙醇反应的机理,醇脱氢酸脱羟基,所以酯化后得到的酯为RCOOC2H5分子组成上比原羧酸多了C2H4,假设酸是一元酸,那么可以算得1mol酸充分酯化反应之后增重应为28g,0.5mol某羧酸与足量乙醇发生酯化反应,生成酯的质量比原羧酸的质量增加了28g,因此不是一元酸,而是二元酸,所以是选项中的乙二酸,故选B.
点评 本题考查学生酯化反应的实质,难度不大,注意酯化反应的水分子是酸掉羟基醇掉氢原子后生成的.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
10.室温下,下列溶液等体积混合后,所得溶液的pH一定大于7的是( )
| A. | 0.1mol/L的盐酸溶液和0.1 mol/L的NaOH溶液 | |
| B. | pH=1的盐酸溶液和pH=13的Ba(OH)2溶液 | |
| C. | pH=4的醋酸溶液和pH=10的NaOH溶液 | |
| D. | pH=4的盐酸溶液和pH=10的NH3•H2O溶液 |
8.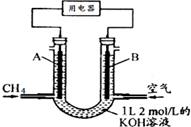 将CH4设计成燃料电池,其利用率更高,装置如图所示(A、B为多孔性碳棒)持续通入甲烷,在标准状况下,消耗甲烷体积VL.则下列说法正确的是( )
将CH4设计成燃料电池,其利用率更高,装置如图所示(A、B为多孔性碳棒)持续通入甲烷,在标准状况下,消耗甲烷体积VL.则下列说法正确的是( )
 将CH4设计成燃料电池,其利用率更高,装置如图所示(A、B为多孔性碳棒)持续通入甲烷,在标准状况下,消耗甲烷体积VL.则下列说法正确的是( )
将CH4设计成燃料电池,其利用率更高,装置如图所示(A、B为多孔性碳棒)持续通入甲烷,在标准状况下,消耗甲烷体积VL.则下列说法正确的是( )| A. | OH-由A端移向B端 | |
| B. | 0<V≤22.4L时,电池总反应的化学方程式为:CH4+2O2+KOH═KHCO3+2H2O | |
| C. | 22.4L<V≤44.8L时,负极电极反应为:CH4-8e-+9CO32-+3H2O=10HCO3- | |
| D. | V=33.6L时,溶液中阴离子浓度大小关系为:c(CO32- )>c(HCO3- )>c(OH-) |
15.对实验①中和滴定;②中和热的测定;③实验室制备乙烯;④实验室用自来水制蒸馏水.下列叙述不正确的是( )
| A. | ①④都要用到锥形瓶 | B. | ②③都要用到温度计 | ||
| C. | ③④都要用到酒精灯 | D. | ①②都要用到指示剂 |
5.下列有关物质的组成、性质、用途的说法.正确的是( )
①Na2O2中的阳离子和阴离子个数比为1:1
②常温下铝制容器可储运浓硫酸或浓硝酸
③盐酸既有氧化性又有还原性
④NO2,Fe(OH)3,FeC12都能直接通过化合反应制备
⑤H2S能使酸性高锰酸钾溶液褪色.所以它具有漂白性.
①Na2O2中的阳离子和阴离子个数比为1:1
②常温下铝制容器可储运浓硫酸或浓硝酸
③盐酸既有氧化性又有还原性
④NO2,Fe(OH)3,FeC12都能直接通过化合反应制备
⑤H2S能使酸性高锰酸钾溶液褪色.所以它具有漂白性.
| A. | ②③④ | B. | ①②③ | C. | ①②③④ | D. | ①②③⑤ |
12.下列叙述中正确的是( )
| A. | 核外电子排布完全相同的两种微粒,其化学性质一定相同 | |
| B. | 凡单原子形成的离子,一定具有稀有气体元素原子的核外电子排布 | |
| C. | 核外电子排布相同的两中性原子一定属于同种元素 | |
| D. | 阴离子的核外电子排布一定与上一周期稀有气体元素原子的核外电子排布相同 |
4.下列关于电解质溶液中粒子浓度关系的说法不正确的是( )
| A. | 0.1 mol/L的NaHCO3溶液中粒子浓度的关系:c(Na+)=c(HCO3-)+c(H2CO3)+2c(CO32-) | |
| B. | 0.2 mol/L的HCl和0.1 mol/L的NH3•H2O等体积混合后溶液中的离子浓度关系: c(Cl-)>c(H+)>c(NH4+)>c(OH-) | |
| C. | pH相同的CH3COONa溶液、Na2CO3溶液、NaOH溶液:c(CH3COONa)>c(Na2CO3)>c(NaOH) | |
| D. | 0.1 mol/L的NaHS溶液中粒子浓度关系:c(S2-)+c(OH-)=(H+)+c(H2S) |
5.下列物质不属于同分异构体的是( )
| A. | 葡萄糖和果糖 | B. | 蔗糖和麦芽糖 | ||
| C. | 甘氨酸和硝基乙烷 | D. | 淀粉和纤维素 |


 ,含共轭结构的原料可以是
,含共轭结构的原料可以是 或
或 .(写结构简式)
.(写结构简式) 的合成路线(其他无机试剂任选).
的合成路线(其他无机试剂任选). .
.