题目内容
17.用NA表示阿伏伽德罗常数的值.下列叙述不正确的是( )| A. | 含4molSi-O键的二氧化硅晶体中氧原子数为2NA | |
| B. | 标准状况下,含3NA个σ键的甲醛分子所占的体积约为22.4L | |
| C. | 2molNO和1molO2混合,在密闭容器中充分反应,容器内的分子数小于2NA | |
| D. | 1molFe与一定量的硝酸反应,转移的电子数为0.2NA~0.3NA |
分析 A.1mol二氧化硅中含有4mol硅氧键,含有2mol氧原子;
B.甲醛分子中含有3个σ键,据此计算出甲醛的物质的量,然后根据V=nVm计算出标准状况下甲醛的体积;
C.2molNO和1molO2混合生成2mol二氧化氮,由于部分二氧化氮转化成四氧化二氮;
D.若为浓硝酸,浓硝酸与铁发生钝化,阻止了反应的进行.
解答 解:A.含4mol Si-O键的二氧化硅的物质的量为1mol,1mol二氧化硅中含有2mol氧原子,氧原子数为2NA,故A正确;
B.含3NA个σ键的甲醛的物质的量为1mol,1mol甲醛在标准状况下的气体较为22.4L,故B正确;
C.2molNO和1molO2混合恰好生成2mol二氧化氮,由于二氧化氮与四氧化二氮存在转化平衡,则容器内分子的物质的量小于1mol,分子数小于2NA,故C正确;
D.1molFe与一定量的硝酸反应,若为浓硝酸,则发生钝化,转移的电子小于0.2NA,故D错误;
故选D.
点评 本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,准确弄清分子、原子、原子核内质子中子及核外电子的构成关系.有利于培养学生的逻辑推理能力,提高学生灵活运用基础知识解决实际问题的能力.

练习册系列答案
相关题目
7.向下列溶液中分别加入钠的小颗粒,溶液里无固体析出的是( )
| A. | BaCl2溶液 | B. | NaOH饱和溶液 | C. | CuSO4溶液 | D. | 盐酸 |
8.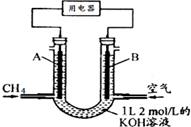 将CH4设计成燃料电池,其利用率更高,装置如图所示(A、B为多孔性碳棒)持续通入甲烷,在标准状况下,消耗甲烷体积VL.则下列说法正确的是( )
将CH4设计成燃料电池,其利用率更高,装置如图所示(A、B为多孔性碳棒)持续通入甲烷,在标准状况下,消耗甲烷体积VL.则下列说法正确的是( )
 将CH4设计成燃料电池,其利用率更高,装置如图所示(A、B为多孔性碳棒)持续通入甲烷,在标准状况下,消耗甲烷体积VL.则下列说法正确的是( )
将CH4设计成燃料电池,其利用率更高,装置如图所示(A、B为多孔性碳棒)持续通入甲烷,在标准状况下,消耗甲烷体积VL.则下列说法正确的是( )| A. | OH-由A端移向B端 | |
| B. | 0<V≤22.4L时,电池总反应的化学方程式为:CH4+2O2+KOH═KHCO3+2H2O | |
| C. | 22.4L<V≤44.8L时,负极电极反应为:CH4-8e-+9CO32-+3H2O=10HCO3- | |
| D. | V=33.6L时,溶液中阴离子浓度大小关系为:c(CO32- )>c(HCO3- )>c(OH-) |
5.下列有关物质的组成、性质、用途的说法.正确的是( )
①Na2O2中的阳离子和阴离子个数比为1:1
②常温下铝制容器可储运浓硫酸或浓硝酸
③盐酸既有氧化性又有还原性
④NO2,Fe(OH)3,FeC12都能直接通过化合反应制备
⑤H2S能使酸性高锰酸钾溶液褪色.所以它具有漂白性.
①Na2O2中的阳离子和阴离子个数比为1:1
②常温下铝制容器可储运浓硫酸或浓硝酸
③盐酸既有氧化性又有还原性
④NO2,Fe(OH)3,FeC12都能直接通过化合反应制备
⑤H2S能使酸性高锰酸钾溶液褪色.所以它具有漂白性.
| A. | ②③④ | B. | ①②③ | C. | ①②③④ | D. | ①②③⑤ |
12.下列叙述中正确的是( )
| A. | 核外电子排布完全相同的两种微粒,其化学性质一定相同 | |
| B. | 凡单原子形成的离子,一定具有稀有气体元素原子的核外电子排布 | |
| C. | 核外电子排布相同的两中性原子一定属于同种元素 | |
| D. | 阴离子的核外电子排布一定与上一周期稀有气体元素原子的核外电子排布相同 |
2.下列物质性质与应用对应关系正确的是( )
| A. | NaHCO3能与碱反应,可用作焙制糕点的膨松剂 | |
| B. | 液氨汽化时吸收大量的热,可用作制冷剂 | |
| C. | 硅酸钠溶液呈碱性,可用作木材防火剂 | |
| D. | Fe比Cu活泼,可用FeCl3溶液腐蚀线路板上的Cu |
4.下列关于电解质溶液中粒子浓度关系的说法不正确的是( )
| A. | 0.1 mol/L的NaHCO3溶液中粒子浓度的关系:c(Na+)=c(HCO3-)+c(H2CO3)+2c(CO32-) | |
| B. | 0.2 mol/L的HCl和0.1 mol/L的NH3•H2O等体积混合后溶液中的离子浓度关系: c(Cl-)>c(H+)>c(NH4+)>c(OH-) | |
| C. | pH相同的CH3COONa溶液、Na2CO3溶液、NaOH溶液:c(CH3COONa)>c(Na2CO3)>c(NaOH) | |
| D. | 0.1 mol/L的NaHS溶液中粒子浓度关系:c(S2-)+c(OH-)=(H+)+c(H2S) |
1.工业上由二氧化锰制备高锰酸钾可分二步进行,第一步:二氧化锰与氢氧化钾共熔并通入氧气2MnO2+4KOH+O2═2K2MnO4+2H2O;第二步:电解锰酸钾溶液:2K2MnO4+2H2O$\frac{\underline{\;电解\;}}{\;}$2KMnO4+H2↑+2KOH则下列说法正确的是( )
| A. | 根据上述过程,每生成1molKMnO4,共转移6mol电子 | |
| B. | 第二步电解时,阳极电极反应式为2MnO42--2e-=2MnO4- | |
| C. | 第二步电解的离子方程式为:2H2O$\frac{\underline{\;电解\;}}{\;}$H2↑+OH- | |
| D. | 第二步电解时阴极周围pH减小 |
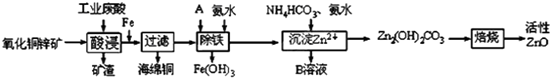
2.某科研小组设计出利用工业废酸(稀H2SO4)来浸取某废弃的氧化铜锌矿的方案,实现废物综合利用,方案如下图所示.
已知:各离子开始沉淀及完全沉淀时的pH如下表所示.
请回答下列问题:
(1)在“酸浸”步骤中,为提高浸出速率,除通入空气“搅拌”外,还可采取的措施是适当升高温度(或增大酸浓度、将氧化铜锌矿粉碎等).(任写一点即可)
(2)氧化铜锌矿中含有少量的CuS和ZnS,在H2SO4的作用下ZnS可以溶解而CuS不溶,
则相同温度下:Ksp(CuS)<Ksp(ZnS)(选填“>”“<”或“=”).
(3)物质A是用来将ZnSO4溶液中的Fe2+转化为Fe3+最好使用下列物质中的B.
A.KMnO4B.H2O2 C.HNO3 D.NaClO
(4)除铁过程中加入氨水的目的是通过调节溶液的pH,使Fe3+沉淀而Zn2+不沉淀,pH应控制在3.2≤pH<6.2或3.2~6.2范围之间.
(5)物质B可直接用作氮肥,则B的化学式是(NH4)2SO4.
(6)写出最后焙烧生成ZnO的化学反应方程式Zn2(OH)2CO3=2ZnO+H2O+CO2↑.

已知:各离子开始沉淀及完全沉淀时的pH如下表所示.
| 离子 | 开始沉淀时的pH | 完全沉淀时的pH |
| Fe2+ | 6.34 | 9.7 |
| Fe3+ | 1.48 | 3.2 |
| Zn2+ | 6.2 | 8.0 |
(1)在“酸浸”步骤中,为提高浸出速率,除通入空气“搅拌”外,还可采取的措施是适当升高温度(或增大酸浓度、将氧化铜锌矿粉碎等).(任写一点即可)
(2)氧化铜锌矿中含有少量的CuS和ZnS,在H2SO4的作用下ZnS可以溶解而CuS不溶,
则相同温度下:Ksp(CuS)<Ksp(ZnS)(选填“>”“<”或“=”).
(3)物质A是用来将ZnSO4溶液中的Fe2+转化为Fe3+最好使用下列物质中的B.
A.KMnO4B.H2O2 C.HNO3 D.NaClO
(4)除铁过程中加入氨水的目的是通过调节溶液的pH,使Fe3+沉淀而Zn2+不沉淀,pH应控制在3.2≤pH<6.2或3.2~6.2范围之间.
(5)物质B可直接用作氮肥,则B的化学式是(NH4)2SO4.
(6)写出最后焙烧生成ZnO的化学反应方程式Zn2(OH)2CO3=2ZnO+H2O+CO2↑.