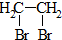题目内容
10.(1)有机物A只含C、H、O三种元素,其中氧元素的质量分数为$\frac{16}{31}$,其相对分子质量为62,A经催化氧化生成B,B经催化氧化生成C,A与C在一定条件下反应可生成一种环状化合物D,则A与C反应生成D的反应类型为取代反应(或酯化反应),化学方程式为HOOC-COOH+HOCH2-CH2OH$→_{△}^{浓硫酸}$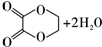 ,B的结构简式为OGC-CHO.
,B的结构简式为OGC-CHO.(2)对有机物E的组成、结构、性质进行观察、分析,得到的实验结果如下:
①E的蒸汽密度是同温同压下氧气密度的5.19倍;
②完全燃烧16.6g有机物E,得到35.2g CO2和5.4g H2O;
③核磁共振氢谱显示E分子中只有2种不同结构位置的氢原子;
④E为无色晶体,微溶于水,易溶于Na2CO3溶液,放出无色气体.
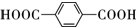
E的分子式为C8H6O4,结构简式为
(3)A与E在一定条件下反应可生成一种常见合成纤维,该高分子化合物的结构简式为
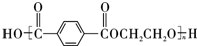 .
.(4)E的一种同分异构体(与E具有相同的官能团),在一定条件下可发生分子内脱水生成一种含有五元环和六元环的有机物F,F的结构简式为
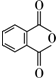 .
.(5)C可将酸性高锰酸钾溶液还原,所得还原产物为Mn2+,该反应的离子方程式为5H2C2O4+2MnO4-+6H+=10CO2↑+2Mn2++8H2O.
分析 (1)有机物A只含C、H、O三种元素,A经催化氧化生成B,B经催化氧化生成C,为醇→醛→酸的转化,氧元素的质量分数为$\frac{16}{31}$,其相对分子质量为62,则氧原子数目为2,A与C在一定条件下反应可生成一种环状化合物F,说明A至少含有两个羟基,可推知A为HOCH2CH2OH,B为OHC-CHO,C为HOOC-COOH;
(2)①E的蒸汽密度是同温同压下氧气密度的5.19倍,则E的相对分子质量为32×5.19=166,②完全燃烧16.6g有机物E,得到35.2g CO2和5.4g H2O,E为0.01mol、二氧化碳为0.8mol、水为0.3mol,则E的分子式C8H6O4,③核磁共振氢谱显示E分子中只有2种不同结构位置的氢原子,④E为无色晶体,微溶于水,易溶于Na2CO3溶液,放出无色气体,说明E中含有-COOH,则E为 ;
;
(3)乙二醇与 发生缩聚反应得到高聚物;
发生缩聚反应得到高聚物;
(4)E的一种同分异构体(与E具有相同的官能团),在一定条件下可发生分子内脱水生成一种含有五元环和六元环的有机物F,应是邻苯二甲酸脱水;
(5)草酸可将酸性高锰酸钾溶液还原,所得还原产物为Mn2+,草酸被氧化为二氧化碳.
解答 解:(1)有机物A只含C、H、O三种元素,A经催化氧化生成B,B经催化氧化生成C,为醇→醛→酸的转化,氧元素的质量分数为$\frac{16}{31}$,其相对分子质量为62,则氧原子数目为2,A与C在一定条件下反应可生成一种环状化合物F,说明A至少含有两个羟基,可推知A为HOCH2CH2OH,B为OHC-CHO,C为HOOC-COOH,A与C反应生成D的反应方程式为:HOOC-COOH+HOCH2-CH2OH$→_{△}^{浓硫酸}$ ,属于取代反应(或酯化反应),
,属于取代反应(或酯化反应),
故答案为:取代反应(或酯化反应);HOOC-COOH+HOCH2-CH2OH$→_{△}^{浓硫酸}$ ;OHC-CHO;
;OHC-CHO;
(2)①E的蒸汽密度是同温同压下氧气密度的5.19倍,则E的相对分子质量为32×5.19=166,②完全燃烧16.6g有机物E,得到35.2g CO2和5.4g H2O,E为0.01mol、二氧化碳为0.8mol、水为0.3mol,则E的分子式C8H6O4,③核磁共振氢谱显示E分子中只有2种不同结构位置的氢原子,④E为无色晶体,微溶于水,易溶于Na2CO3溶液,放出无色气体,说明E中含有-COOH,则E为 ,
,
故答案为:C8H6O4; ;
;
(3)乙二醇与 发生缩聚反应得到高聚物,该高分子化合物的结构简式为
发生缩聚反应得到高聚物,该高分子化合物的结构简式为 ,
,
故答案为: ;
;
(4)E的一种同分异构体(与E具有相同的官能团),在一定条件下可发生分子内脱水生成一种含有五元环和六元环的有机物F,应是邻苯二甲酸脱水,F的结构简式为: ,故答案为:
,故答案为: ;
;
(5)草酸可将酸性高锰酸钾溶液还原,所得还原产物为Mn2+,草酸被氧化为二氧化碳,反应离子方程式为:5H2C2O4+2MnO4-+6H+=10CO2↑+2Mn2++8H2O,
故答案为:5H2C2O4+2MnO4-+6H+=10CO2↑+2Mn2++8H2O.
点评 本题考查有机物推断、官能团的结构与性质、氧化还原反应等,掌握燃烧法利用原子守恒确定有机物分子式,熟练掌握官能团的性质,难度中等.

 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案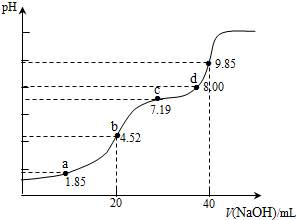
| A. | a点所得溶液中:2c(H2SO3)+c(SO32-)=0.1 mol•L-1 | |
| B. | b点所得溶液中:c(H2SO3)+c(H+)=c(SO32-)+c(OH-) | |
| C. | c点所得溶液中:c(SO32-)=c(HSO3-) | |
| D. | d点所得溶液中:c(Na+)>c(SO32-)>c(HSO3-) |
①Na2O2中的阳离子和阴离子个数比为1:1
②常温下铝制容器可储运浓硫酸或浓硝酸
③盐酸既有氧化性又有还原性
④NO2,Fe(OH)3,FeC12都能直接通过化合反应制备
⑤H2S能使酸性高锰酸钾溶液褪色.所以它具有漂白性.
| A. | ②③④ | B. | ①②③ | C. | ①②③④ | D. | ①②③⑤ |
| A. | NaHCO3能与碱反应,可用作焙制糕点的膨松剂 | |
| B. | 液氨汽化时吸收大量的热,可用作制冷剂 | |
| C. | 硅酸钠溶液呈碱性,可用作木材防火剂 | |
| D. | Fe比Cu活泼,可用FeCl3溶液腐蚀线路板上的Cu |
(1)下表列举了不同温度下大气固氮的部分平衡常数K值.
| 反应 | 大气固氮N2(g)+O2(g)?2NO(g) | |
| 温度/℃ | 27 | 2260 |
| K | 3.84×10-31 | 1 |
②2260℃时,向2L密闭容器中充入0.3mol N2和0.3mol O2,20s时反应达平衡.则此时得到NO0.2mol,用N2表示的平均反应速率为0.0025mol/(L•s).
(2)已知工业固氮反应:N2(g)+3H2 (g)?2NH3 (g)△H<0,在其他条件相同时,分别测定此反应中N2的平衡转化率随压强和温度(T)变化的曲线如下图A、B所示,其中正确的是B(填“A”或“B”),T1>T2(填“>”或“<”).

(3)20世纪末,科学家采用高质子导电性的SCY陶瓷(能传递H+)为介质,用吸附在它内外表面上的金属钯多晶薄膜做电极,通过电解实现高温常压下的电化学合成氨.其示意图如C所示,阴极的电极反应式为N2+6e-+6H+=2NH3
(4)近年,又有科学家提出在常温、常压、催化剂等条件下合成氨的新思路,反应原理为:
2N2 (g)+6H2 0(l)?4NH3(aq)+302(g)△H
已知:N2 (g)+3H2(g)?2NH3 (g)△H1
2H2(g)+02 (g)?2H2 0(1)△H2
NH3 (g)?NH3(aq)△H3
则△H=2△H1-3△H2+4△H3(用含△H1、△H2、△H3的式子表示).
| A. | 标准状况下,22.4 L NH3溶于水后溶液中含有NA个NH4+ | |
| B. | 1L 0.1 mol•L-1的Na2CO3溶液中含有0.2 NA个Na+ | |
| C. | 1 mol 硫酸钾中阴离子所带电荷数为NA | |
| D. | 将0.1mol氯化铁溶于1L水中,所得溶液中含有0.1NAFe3+ |
 .
.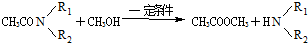
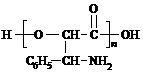 或
或 ;
;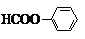 或
或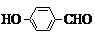 .
.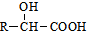 ②R′COOH$\stackrel{PCI_{3}}{→}$R′COCl
②R′COOH$\stackrel{PCI_{3}}{→}$R′COCl