题目内容
6.如表所示的是元素周期表中一部分,表中所列出的字母分别代表着某一化学元素.根据下表中所列元素回答下列中的问题.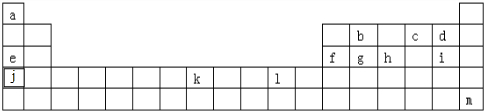
(1)最活泼非金属元素名称是氟;最高价氧化物对应的水化物酸性最强的化合物的化学式是HClO4;
(2)元素m的原子结构示意图为
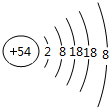
(3)元素k在周期表的位置是第四周期第Ⅷ族,k3+的检验方法取含有Fe3+的溶液,滴加KSCN溶液,溶液被血红色.
(4)l有两种氧化物A,B,其中A高温下可分解,方程式为4CuO$\frac{\underline{\;高温\;}}{\;}$2Cu2O+O2↑,现象为黑色物质变为砖红色,一定质量的A,B混合物加热至质量不在变化,固体质量减少了48克,则混合物中A的物质的量为6mol
(5)c、e、f、i的简单离子的半径由大到小的顺序Cl->O2->Na+>Al3+(填离子符号);
g、b、i的氢化物稳定性由大到小的顺序为HCl>CH4>SiH4(填化学式).
(6)e的最高价氧化物对应的水化物不能装在带磨口玻璃塞的试剂瓶,请用离子方程式说明其原因SiO2+2OH-=SiO32-+H2O.
分析 由元素在周期表中的位置可知,a为H,b为C,c为O,d为F,e为Na,f为Al,g为Si,h为P,i为Cl,j为K,k为Fe,l为Cu,m为Xe;
(1)同周期自左而右非金属性增强、同主族自上而下非金属性减弱;F元素没有最高价含氧酸,最高价氧化物对应的水化物酸性最强是高氯酸;
(2)m为Xe,原子核外有5个电子层,各层电子数为2、8、18、18、8;
(3)由元素位置可知,元素k在周期表的位置是:第四周期第Ⅷ族,用KSN溶液检验Fe3+;
(4)Cu的两种氧化物为CuO、Cu2O,Cu2O中Cu的3d轨道为全满状态,较稳定,高温下CuO可以分解生成Cu2O,会有氧气生成,结合差量法计算混合物中CuO的质量,进而计算其物质的量;
(5)电子层结构相同的离子,核电荷数越大离子半径越小,离子电子层越多离子半径越大;元素的非金属性越强,对应氢化物越稳定;
(6)e的最高价氧化物对应水化物为NaOH,氢氧化钠能与二氧化硅反应生成硅酸钠.
解答 解:由元素在周期表中的位置可知,a为H,b为C,c为O,d为F,e为Na,f为Al,g为Si,h为P,i为Cl,j为K,k为Fe,l为Cu,m为Xe;
(1)同周期自左而右非金属性增强、同主族自上而下非金属性减弱,故上述元素正确氟元素非金属性最强,F元素没有最高价含氧酸,最高价氧化物对应的水化物酸性最强是HClO4,
故答案为:氟;HClO4;
(2)m为Xe,原子核外有5个电子层,各层电子数为2、8、18、18、8,原子结构示意图为 ,故答案为:
,故答案为: ;
;
(3)由元素位置可知,元素k在周期表的位置是:第四周期第Ⅷ族,用检验Fe3+方法:取含有Fe3+的溶液,滴加KSCN溶液,溶液被血红色,
故答案为:第四周期第Ⅷ族;取含有Fe3+的溶液,滴加KSCN溶液,溶液被血红色;
(4)Cu的两种氧化物为CuO、Cu2O,Cu2O中Cu的3d轨道为全满状态,较稳定,高温下CuO可以分解生成Cu2O,会有氧气生成,反应方程式为:4CuO$\frac{\underline{\;高温\;}}{\;}$2Cu2O+O2↑,现象是:黑色物质变为砖红色,
设混合物中CuO的质量为xg,则:
4CuO$\frac{\underline{\;高温\;}}{\;}$2Cu2O+O2↑ 质量减少
4×80 32
xg 48g
所以4×80:32=xg:48g
解得x=480g,
故CuO的物质的量为$\frac{480g}{80g/mol}$=6mol,
故答案为:4CuO$\frac{\underline{\;高温\;}}{\;}$2Cu2O+O2↑;黑色物质变为砖红色;6mol;
(5)电子层结构相同的离子,核电荷数越大离子半径越小,离子电子层越多离子半径越大,故离子半径:Cl->O2->Na+>Al3+;
非金属性Cl>C>Si,元素的非金属性越强,对应氢化物越稳定,故氢化物稳定性HCl>CH4>SiH4,
故答案为:Cl->O2->Na+>Al3+;HCl>CH4>SiH4;
(6)e的最高价氧化物对应水化物为NaOH,氢氧化钠能与二氧化硅反应生成硅酸钠,反应离子方程式为:SiO2+2OH-=SiO32-+H2O,
故答案为:SiO2+2OH-=SiO32-+H2O.
点评 本题考查元素周期表与元素周期律综合运用,题目综合性较强,涉及知识点较多,是对学生综合能力的考查,注意对基础知识的理解掌握.

 阅读快车系列答案
阅读快车系列答案| A. | 0.1mol/L NaHCO3溶液与0.1mol/L NaOH溶液等体积混合,所得溶液中:C(Na+)>c(CO32-)>c(HCO3- )>c(OH-) | |
| B. | 20ml 0.1mol/L CH3COONa溶液与10ml0.1mol/L HCl溶液混合后溶液呈酸性,所得溶中:C(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+) | |
| C. | 室温下,pH=2的盐酸与pH=12的氨水等体积混合,所得溶液中:c(Cl-)+c(H+)>c(NH4+ )+c(OH-) | |
| D. | 0.1mol/L CH3COOH溶液与0.1mol/L NaOH溶液等体积混合,所得溶液中:c(OH-)>c(H+)+c(CH3COOH) |
| A. | NaCl | B. | KCl | C. | CaCl2 | D. | AlCl3 |
| A. | NH4+ | B. | H3O+ | C. | CO2 | D. | CCl4 |
| A. | 3s2 3p3 | B. | 4s2 | C. | 4s2 4p1 | D. | 3s2 3p5 |

 .
. 四氯化碳
四氯化碳 CO2
CO2 HClO
HClO 氯化铵
氯化铵 Na2O2
Na2O2
