题目内容
16.已知下列元素原子的最外层电子排布式,其中不能表示该元素一定为主族元素的是( )| A. | 3s2 3p3 | B. | 4s2 | C. | 4s2 4p1 | D. | 3s2 3p5 |
分析 主族元素外围电子排布为nsx或ns2npx,但1s2为He,为零族元素,最外层电子数为的4s2元素可能为过渡元素,据此进行判断.
解答 解:A.最外层电子排布式为3s23p3,处于第三周期ⅤA族,故A不选;
B.最外层电子数为的4s2元素可能为Ca或部分过渡元素,故B选;
C.最外层电子排布式为4s24p1,处于第四周期ⅢA族,故C不选;
D.最外层电子排布式为3s23p5,处于第三周期ⅦA族,故D不选;
故选B.
点评 本题考查原子结构与位置关系,题目难度不大,注意选项中为最外层电子数排布,不是价电子排布,明确原子核外电子排布规律为解答关键.

练习册系列答案
 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案
相关题目
7.下列有关海水综合利用的说法不正确的是( )
| A. | 海水资源的利用包括海水水资源利用和化学资源利用 | |
| B. | 海水晒盐的过程中只发生了物理变化 | |
| C. | 从海水中可以得到NaCl,电解熔融NaCl可制备Cl2 | |
| D. | 海水中金元素总储量很大,适合于大规模工业开采 |
4.NA为阿伏伽德罗常数的值.下列说法正确的是( )
| A. | 18gD2O中含有的质子数均为10NA | |
| B. | 2L0.5mol/L硫酸溶液中含有氢离子数目为NA | |
| C. | 标准状况下,22.4LSO3所含有的分子数目为NA | |
| D. | 过氧化钠与水反应时生成0.1mol氧气转移的电子数为0.2NA |
11.下列两种气体的分子数一定不相等的是( )
| A. | 质量相等密度不等的N2和C2H4 | B. | 等体积等密度的CO和C2H4 | ||
| C. | 等温、等压,等体积的O2和N2 | D. | 常温常压下,等质量的NO和CO |
8.下列两种物质发生反应 ①Na和O2 ②NaAlO2溶液与盐酸 ③水玻璃与CO2 ④Fe与Cl2 ⑤FeI2溶液和Cl2,因反应物用量或反应条件的不同而生成不同产物的是( )
| A. | ①②④ | B. | ①②③⑤ | C. | ①②⑤ | D. | ①③⑤ |
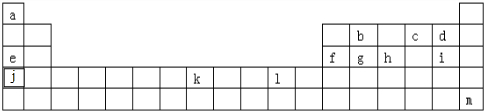
5.下表为元素周期表的一部分,表中列出了10种元素在周期表中的位置,按要求完成下列各小题.
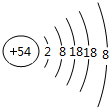
(1)化学性质最不活泼的元素的原子结构示意图为
(2)元素⑧的名称为溴,其最高价氧化物的水化物的化学式为HBrO4
(3)用电子式表示元素②与元素⑨形成化合物的过程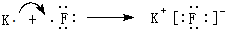
(4)非金属性最强的元素是F(填元素符号);除0族外原子半径最大的元素是K (填元素符号);元素①的一种氧化物中既含有离子键又有共价键,它的电子式是
(5)①、③、⑨三种元素形成的简单离子半径由大到小的顺序为F->Na+>Mg2+(用离子符号表示)
(6)元素③和⑦形成的化合物与水能剧烈反应,其反应的实质是阴阳离子分别与水电离产生的H+和OH-离子重新组合,生成新的物质,写出该反应的化学方程式Mg3N2+6H2O=3Mg(OH)2+2NH3↑.
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ⑥ | ⑦ | ⑨ | |||||
| 3 | ① | ③ | ⑤ | ⑩ | ||||
| 4 | ② | ④ | ⑧ |

(2)元素⑧的名称为溴,其最高价氧化物的水化物的化学式为HBrO4
(3)用电子式表示元素②与元素⑨形成化合物的过程

(4)非金属性最强的元素是F(填元素符号);除0族外原子半径最大的元素是K (填元素符号);元素①的一种氧化物中既含有离子键又有共价键,它的电子式是

(5)①、③、⑨三种元素形成的简单离子半径由大到小的顺序为F->Na+>Mg2+(用离子符号表示)
(6)元素③和⑦形成的化合物与水能剧烈反应,其反应的实质是阴阳离子分别与水电离产生的H+和OH-离子重新组合,生成新的物质,写出该反应的化学方程式Mg3N2+6H2O=3Mg(OH)2+2NH3↑.
6.如图所示,电极a与b均为石墨棒,在电解过程中,下列说法正确的是( )
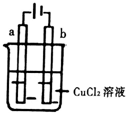

| A. | 电极a表面呈红色 | |
| B. | 电极b作阳极 | |
| C. | 电子由电源的正极沿导线流向电极a | |
| D. | 当电路中通过0.2mol电子时,理论上b电极质量增加6.4g |
 .
. ,ZW与水反应放出气体的化学方程式为NaH+H2O═NaOH+H2↑.
,ZW与水反应放出气体的化学方程式为NaH+H2O═NaOH+H2↑.