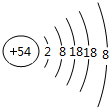
题目内容
18.表为元素周期表的一部分,请参照元素①-⑧在表中的位置,用化学用语回答下列问题: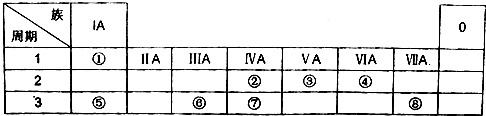
(1)④、⑤、⑥的原子半径由大到小的顺序为Na>Al>O.(用元素符号表示)
(2)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是HNO3>H2CO3>H2SiO3 .(用分子时表示)
(3)①、④、⑤、⑧中的某些元素可形成既含离子键又含共价键的化合物,写出其中一种化合物的化学式NaOH.
(4)④和⑤形成的一种化合物能与水发生化合反应,则该化合物电子式为
 .
.(5)由表中①④元素的原子按1:1组成的化合物的稀溶液易被催化分解,通常使用的催化剂为(填序号)ab.
a.MnO2 b.FeCl3 c.Na2SO3 d.KMnO4
(6)⑤、⑥各自的最高价氧化物对应水化物相互反应的离子方程式为Al(OH)3+OH-=AlO2-+2H2O.
分析 由元素在周期表中的位置可知,①为H、②为C、③为N、④为O、⑤为Na、⑥为Al、⑦为Si、⑧为Cl.(1)同周期自左而右原子半径减小,同主族自上而下原子半径增大;
(2)非金属性越强,最高价含氧酸的酸性越强;
(3)由H、O、Na、Cl元素中的某些元素可形成既含离子键又含共价键的化合物有氢氧化钠、过氧化钠等;
(4)④和⑤形成的一种化合物能与水发生化合反应,该化合物为过氧化钠,由钠离子与过氧根离子构成;
(5)表中两种元素的原子按1:1组成的常见液态化合物为H2O2,在MnO2或FeCl3催化作用下分解,而Na2SO3具有还原性,与H2O2发生氧化还原反应,高锰酸钾具有强氧化性,与H2O2发生氧化还原反应;
(6)⑤、⑥各自的最高价氧化物对应水化物分别为氢氧化钠、氢氧化铝,二者反应生成偏铝酸钠与水.
解答 解:由元素在周期表中的位置可知,①为H、②为C、③为N、④为O、⑤为Na、⑥为Al、⑦为Si、⑧为Cl.
(1)同周期自左而右原子半径减小,同主族自上而下原子半径增大,故原子半径:Na>Al>O,故答案为:Na>Al>O;
(2)非金属性:N>C>Si,元素的非金属性越强,对应的最高价含氧酸的酸性越强,则HNO3>H2CO3>H2SiO3 ,故答案为:HNO3>H2CO3>H2SiO3 ;
(3)由H、O、Na、Cl元素中的某些元素可形成既含离子键又含共价键的化合物有氢氧化钠、过氧化钠等,故答案为:NaOH;
(4)④和⑤形成的一种化合物能与水发生化合反应,该化合物为过氧化钠,由钠离子与过氧根离子构成,电子式为 ,故答案为:
,故答案为: ;
;
(5)两种元素的原子按1:1组成的常见液态化合物为H2O2,在MnO2或FeCl3催化作用下分解,而Na2SO3具有还原性,与H2O2发生氧化还原反应,不能用作催化剂,高锰酸钾具有强氧化性,与H2O2发生氧化还原反应,也不能作催化剂,
故答案为:ab;
(6)⑤、⑥各自的最高价氧化物对应水化物分别为氢氧化钠、氢氧化铝,二者反应生成偏铝酸钠与水,反应离子方程式为:Al(OH)3+OH-=AlO2-+2H2O,
故答案为:Al(OH)3+OH-=AlO2-+2H2O.
点评 本题考查元素周期表与周期律的综合应用、常用化学用语、元素化合物性质等,难度不大,掌握元素周期表的结构推断元素是关键,注意基础知识的理解掌握.

 名校课堂系列答案
名校课堂系列答案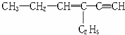 ,分子中含有四面体结构的碳原子(即饱和碳原子)数为a,在同一直线上的碳原子数为b,在同一平面上的碳原子数最多为c,则a、b、c分别为( )
,分子中含有四面体结构的碳原子(即饱和碳原子)数为a,在同一直线上的碳原子数为b,在同一平面上的碳原子数最多为c,则a、b、c分别为( )| A. | 4,3,6 | B. | 4,3,8 | C. | 2,5,4 | D. | 4,4,6 |
| A. | CS2为V形的极性分子 | |
| B. | ClO3-的空间构型为三角锥形 | |
| C. | BF3是三角锥形分子 | |
| D. | SiF4和SO32-的中心原子均为sp2杂化 |
 某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、无水醋酸钠,D中放有饱和碳酸钠溶液.
某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、无水醋酸钠,D中放有饱和碳酸钠溶液.已知:①无水氯化钙可与乙醇形成难溶于水的CaCl2•6C2H5OH
②有关有机物的沸点:
| 试剂 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
| 沸点/℃ | 34.7 | 78.5 | 118 | 77.1 |
(1)浓硫酸的作用:制乙酸、催化剂、脱水剂;若用同位素18O示踪法确定反应产物水分子中氧原子的提供者,写出能表示18O位置的化学方程式:CH3COOH+CH3CH218OH
 CH3CO18OC2H5+H2O.
CH3CO18OC2H5+H2O.(2)球形干燥管C的作用是防止倒吸、冷凝.若反应前向D中加入几滴酚酞,溶液呈红色,产生此现象的原因是(用离子方程式表示)CO32-+H2O?HCO3-+OH-反应结束后D中的现象是溶液分层,上层无色油体液体,下层溶液颜色变浅.
(3)从D中分离出的乙酸乙酯中常含有一定量的乙醇、乙醚和水,应先加入无水氯化钙,分离出乙醇;再加入(此空从下列选项中选择)C;然后进行蒸馏,收集77℃左右的馏分,以得到较纯净的乙酸乙酯:
A.五氧化二磷 B.碱石灰 C.无水硫酸钠 D.生石灰.
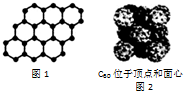
| A. | SiO2晶体中最小环上的原子数为6 | |
| B. | 在晶体中只要有阳离子就一定有阴离子 | |
| C. | 12g石墨烯(如图1)中含有六元环的个数为0.5NA | |
| D. | 720g C60晶体(如图2)中含有0.5NA个晶胞结构单元 |
| A. | 海水资源的利用包括海水水资源利用和化学资源利用 | |
| B. | 海水晒盐的过程中只发生了物理变化 | |
| C. | 从海水中可以得到NaCl,电解熔融NaCl可制备Cl2 | |
| D. | 海水中金元素总储量很大,适合于大规模工业开采 |
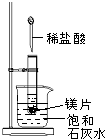 如图所示,把试管放入盛有25℃饱和石灰水的烧杯中,试管开始放入几小块镁片,再用滴管滴入5mL盐酸于试管中.试回答下列问题:
如图所示,把试管放入盛有25℃饱和石灰水的烧杯中,试管开始放入几小块镁片,再用滴管滴入5mL盐酸于试管中.试回答下列问题: