题目内容
15.按要求填空:(1)写出下列微粒的电子式:
N2
 四氯化碳
四氯化碳 CO2
CO2 HClO
HClO 氯化铵
氯化铵 Na2O2
Na2O2
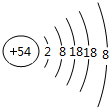
(2)质量数为23,中子数为12的原子的离子结构示意图:

(3)下列物质属于离子晶体③⑤,属于分子晶体的是②⑦,原子 晶体①⑧.
①金刚石 ②干冰 ③氯化钠 ④铜 ⑤氢氧化钠 ⑥铁⑦碘 ⑧水晶.
分析 (1)首先判断化合物是离子化合物还是共价化合物;
若是离子化合物,其电子式 由阴、阳离子的电子式组合而成,相同的离子不能合并;
若是共价化合物,其电子式由对应原子的电子式组成,并要表示出两原子之间的共用电子对情况;
(2)质子数-质量数-中子数;
(3)离子晶体:由阴阳离子按照一定的比例通过离子键集合而成的晶体,强碱、活泼金属氧化物、大多数的盐属于离子晶体;
分子晶体;分子间以范德华力相互结合形成的晶体,大多数非金属单质及其形成的化合物.
解答 解:(1)氮气分子中两个氮原子共用3对电子,电子式为: ;
;
CCl4是共价化合物,碳原子分别与4个氯原子通过一对共用电子对结合,CCl4电子式为 ;
;
CO2是共价化合物,碳原子和氧原子之间有2对共用电子对,其电子式为 ;
;
HClO为共价化合物,分子中存在1个氧氢键和1个Cl-O键,次氯酸的电子式为: ;
;
氯化铵是离子化合物,由氨根离子与氯离子构成,电子式为: ;
;
Na2O2是离子化合物,由Na+离子和O2-离子构成,Na2O2的电子式为 ,故答案为:
,故答案为: ;
; ;
; ;
; ;
; ;
; ;
;
(2)质子数-质量数-中子数=23-12=11,是钠元素,钠原子结构示意图 ,故答案为:
,故答案为: ;
;
(3)根据概念判断:④是金属,属于金属晶体;
②⑦都是由分子通过分子间作用力构成的晶体,属于分子晶体;①金刚石是由碳原子通过共价键结合形成的原子晶体,⑧二氧化硅是有硅原子和氧原子通过共价键结合成的原子晶体;③氯化钠和⑤氢氧化钠都是由阴阳离子通过离子键结合成的离子晶体,
故答案为:③⑤;②⑦;①⑧.
点评 本题考查了电子式、原子结构示意图的书写以及晶体类型的判断,题目难度中等,试题题量较大,充分考查了学生对书写知识的掌握情况,试题有利于培养学生灵活应用所学知识的能力.

练习册系列答案
 优学名师名题系列答案
优学名师名题系列答案
相关题目
3. 某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、无水醋酸钠,D中放有饱和碳酸钠溶液.
某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、无水醋酸钠,D中放有饱和碳酸钠溶液.
已知:①无水氯化钙可与乙醇形成难溶于水的CaCl2•6C2H5OH
②有关有机物的沸点:
请回答:
(1)浓硫酸的作用:制乙酸、催化剂、脱水剂;若用同位素18O示踪法确定反应产物水分子中氧原子的提供者,写出能表示18O位置的化学方程式:CH3COOH+CH3CH218OH CH3CO18OC2H5+H2O.
CH3CO18OC2H5+H2O.
(2)球形干燥管C的作用是防止倒吸、冷凝.若反应前向D中加入几滴酚酞,溶液呈红色,产生此现象的原因是(用离子方程式表示)CO32-+H2O?HCO3-+OH-反应结束后D中的现象是溶液分层,上层无色油体液体,下层溶液颜色变浅.
(3)从D中分离出的乙酸乙酯中常含有一定量的乙醇、乙醚和水,应先加入无水氯化钙,分离出乙醇;再加入(此空从下列选项中选择)C;然后进行蒸馏,收集77℃左右的馏分,以得到较纯净的乙酸乙酯:
A.五氧化二磷 B.碱石灰 C.无水硫酸钠 D.生石灰.
 某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、无水醋酸钠,D中放有饱和碳酸钠溶液.
某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、无水醋酸钠,D中放有饱和碳酸钠溶液.已知:①无水氯化钙可与乙醇形成难溶于水的CaCl2•6C2H5OH
②有关有机物的沸点:
| 试剂 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
| 沸点/℃ | 34.7 | 78.5 | 118 | 77.1 |
(1)浓硫酸的作用:制乙酸、催化剂、脱水剂;若用同位素18O示踪法确定反应产物水分子中氧原子的提供者,写出能表示18O位置的化学方程式:CH3COOH+CH3CH218OH
 CH3CO18OC2H5+H2O.
CH3CO18OC2H5+H2O.(2)球形干燥管C的作用是防止倒吸、冷凝.若反应前向D中加入几滴酚酞,溶液呈红色,产生此现象的原因是(用离子方程式表示)CO32-+H2O?HCO3-+OH-反应结束后D中的现象是溶液分层,上层无色油体液体,下层溶液颜色变浅.
(3)从D中分离出的乙酸乙酯中常含有一定量的乙醇、乙醚和水,应先加入无水氯化钙,分离出乙醇;再加入(此空从下列选项中选择)C;然后进行蒸馏,收集77℃左右的馏分,以得到较纯净的乙酸乙酯:
A.五氧化二磷 B.碱石灰 C.无水硫酸钠 D.生石灰.
10.有关晶体组成结构的叙述中,正确的是( )
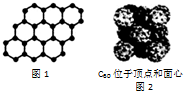

| A. | SiO2晶体中最小环上的原子数为6 | |
| B. | 在晶体中只要有阳离子就一定有阴离子 | |
| C. | 12g石墨烯(如图1)中含有六元环的个数为0.5NA | |
| D. | 720g C60晶体(如图2)中含有0.5NA个晶胞结构单元 |
20.给蒸馏水中滴入少量盐酸后,下列说法中错误的是( )
| A. | c(H+)•c(OH- )乘积不变 | B. | pH增大了 | ||
| C. | c(OH- )降低了 | D. | 水电离出的c(H+)降低了 |
7.下列有关海水综合利用的说法不正确的是( )
| A. | 海水资源的利用包括海水水资源利用和化学资源利用 | |
| B. | 海水晒盐的过程中只发生了物理变化 | |
| C. | 从海水中可以得到NaCl,电解熔融NaCl可制备Cl2 | |
| D. | 海水中金元素总储量很大,适合于大规模工业开采 |
4.NA为阿伏伽德罗常数的值.下列说法正确的是( )
| A. | 18gD2O中含有的质子数均为10NA | |
| B. | 2L0.5mol/L硫酸溶液中含有氢离子数目为NA | |
| C. | 标准状况下,22.4LSO3所含有的分子数目为NA | |
| D. | 过氧化钠与水反应时生成0.1mol氧气转移的电子数为0.2NA |
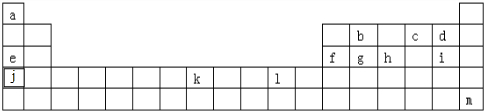
5.下表为元素周期表的一部分,表中列出了10种元素在周期表中的位置,按要求完成下列各小题.
(1)化学性质最不活泼的元素的原子结构示意图为
(2)元素⑧的名称为溴,其最高价氧化物的水化物的化学式为HBrO4
(3)用电子式表示元素②与元素⑨形成化合物的过程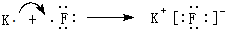
(4)非金属性最强的元素是F(填元素符号);除0族外原子半径最大的元素是K (填元素符号);元素①的一种氧化物中既含有离子键又有共价键,它的电子式是
(5)①、③、⑨三种元素形成的简单离子半径由大到小的顺序为F->Na+>Mg2+(用离子符号表示)
(6)元素③和⑦形成的化合物与水能剧烈反应,其反应的实质是阴阳离子分别与水电离产生的H+和OH-离子重新组合,生成新的物质,写出该反应的化学方程式Mg3N2+6H2O=3Mg(OH)2+2NH3↑.
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ⑥ | ⑦ | ⑨ | |||||
| 3 | ① | ③ | ⑤ | ⑩ | ||||
| 4 | ② | ④ | ⑧ |

(2)元素⑧的名称为溴,其最高价氧化物的水化物的化学式为HBrO4
(3)用电子式表示元素②与元素⑨形成化合物的过程

(4)非金属性最强的元素是F(填元素符号);除0族外原子半径最大的元素是K (填元素符号);元素①的一种氧化物中既含有离子键又有共价键,它的电子式是

(5)①、③、⑨三种元素形成的简单离子半径由大到小的顺序为F->Na+>Mg2+(用离子符号表示)
(6)元素③和⑦形成的化合物与水能剧烈反应,其反应的实质是阴阳离子分别与水电离产生的H+和OH-离子重新组合,生成新的物质,写出该反应的化学方程式Mg3N2+6H2O=3Mg(OH)2+2NH3↑.
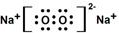 ,该物质所含有的微粒间作用力的类型为离子键、共价键.
,该物质所含有的微粒间作用力的类型为离子键、共价键.