题目内容
8.硫酸亚铁晶体可用于色谱分析试剂,点滴分析铂、硒、亚硝酸盐等.某研究小组进行如下实验:实验一:硫酸亚铁晶体的制取
某酸性FeSO4溶液中含有少量的SnSO4,为得到纯净的硫酸亚铁晶体(FeSO4•xH2O),可向溶液中通入H2S气体至饱和,然后用硫酸酸化至PH=2.过滤后,将所得滤液蒸发浓缩、冷却结晶、过滤洗涤,得到FeSO4•7H2O晶体.查询资料,得有关物质的数据如下表:
| 25℃ | pH | 25℃ | pH |
| 饱和H2S溶液 | 3.9 | FeS开始沉淀 | 3.0 |
| SnS沉淀完全 | 1.5 | FeS沉淀完全 | 5.5 |
(2)检验制得的绿矾晶体中是否含有Fe3+,可选用的试剂为AC.
A.KSCN溶液 B.稀H2SO4 C.淀粉-KI溶液 D.KMnO4溶液
(3)通入H2S至饱和的目的是除去溶液中的Sn2+离子,并防止Fe2+被氧化; 在溶液中用硫酸酸化至PH=2的目的是防止Fe2+离子生成沉淀.
实验二:测定硫酸亚铁晶体中结晶水的数目
某兴趣小组同学称取ag硫酸亚铁晶体样品,按图1装置进行高温加热,使其完全分解(硫酸亚铁晶体在高温条件下分解为三种化合物和一种单质,该单质能使带火星的木条复燃),对所得产物进行探究,并通过称量装置B质量测出x的值.
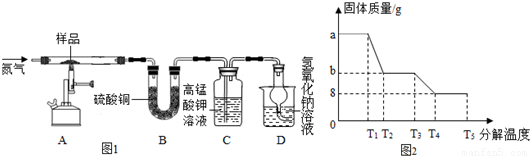
(4)装置B中无水硫酸铜粉末变蓝,质量增加12.6g,说明产物中有水,装置C中高锰酸钾溶液褪色,说明产物中还有二氧化硫.
(5)实验中要持续通入氮气,否则测出的x会偏小(填“偏大”、“偏小”或“不变”).
(6)硫酸亚铁晶体完全分解后装置A中固体呈红棕色,将其加入足量稀盐酸中,固体全部溶解,得黄色溶液,则红棕色固体是Fe2O3(填化学式).
(7)某研究所利用SDTQ600热分析仪对硫酸亚铁晶体进行热分解,获得相关数据,绘制成固体质量--分解温度的关系图如图2,根据图2中有关数据,可计算出x为7.7.
分析 (1)亚铁离子水解使溶液显酸性;
(2)KSCN溶液与Fe3+的溶液反应会使溶液呈血红色,Fe3+有氧化性,能将碘离子氧化成碘单质,碘遇淀粉显蓝色;
(3)依据题中实验过程分析,通入硫化氢至饱和,硫化氢是强还原剂,目的是沉淀锡离子,防止亚铁离子被氧化;在H2S饱和溶液中,SnS沉淀完全时溶液的pH为1.6;FeS开始沉淀时溶液的pH为3.0,加入稀硫酸调节溶液PH=2为了除去杂质离子Sn2+;
(4)二氧化硫能使高锰酸钾溶液褪色;
(5)实验中要持续通入氮气,把水蒸气全部赶出,否则测出的x会偏小;
(6)氧化铁固体呈红棕色,加入足量稀盐酸中,固体全部溶解生成铁离子,得黄色溶液;
(7)通过FeSO4•xH2O的化学式可知铁原子和水的个数比为1:2x,根据原子守恒计算.
解答 解:(1)FeSO4溶液中亚铁离子水解:Fe2++2H2O?Fe(OH)2+2H+,溶液显酸性;
故答案为:Fe2++2H2O?Fe(OH)2+2H+;
(2)KSCN溶液与Fe3+的溶液反应会使溶液呈血红色,Fe3+有氧化性,能将碘离子氧化成碘单质,碘遇淀粉显蓝色,所以检验硫酸亚铁晶体中是否含有Fe3+,可以用KSCN溶液或淀粉-KI溶液;
故答案为:AC;
(3)通入硫化氢至饱和的目的是:硫化氢具有强还原性,可以防止亚铁离子被氧化,已知:在H2S饱和溶液中,SnS沉淀完全时溶液的pH为1.6;FeS开始沉淀时溶液的pH为3.0,沉淀完全时的pH为5.5,在溶液中用硫酸酸化至pH=2的目的是,在溶液PH=2时,Sn2+完全沉淀,亚铁离子不沉淀;
故答案为:除去溶液中的Sn2+离子,并防止Fe2+被氧化;防止Fe2+离子生成沉淀;
(4)二氧化硫有还原性,能使高锰酸钾溶液褪色;
故答案为:二氧化硫;
(5)实验中要持续通入氮气,把水蒸气全部赶出,否则,水蒸气未被充分吸收,测出的x会偏小;
故答案为:偏小;
(6)氧化铁固体呈红棕色,加入足量稀盐酸中,固体全部溶解生成铁离子,得黄色溶液;
故答案为:Fe2O3;
(7)通过FeSO4•xH2O的化学式可知铁原子和水的个数比为1:x,
Fe2O3~2xH2O
160 36x
8g 12.6g
x=7;
故答案为:7.
点评 本题主要考查了学生根据实验原理从资料中获得有效信息的能力、实验分析能力、根据化学式的计算能力等,侧重于考查学生的分析问题和解决问题的能量,注意相关基础知识的学习与积累,难度中等.

 全能测控期末小状元系列答案
全能测控期末小状元系列答案| A. | 参加反应的酸和碱的物质的量相等 | |
| B. | 参加反应的酸中的H+总量和碱中的OH-总量相等 | |
| C. | 反应后混合液的pH=7 | |
| D. | 不能用适当的酸碱指示剂来判断 |

| A. | 为增强导电性,可用金属铜作阳极 | |
| B. | 电解过程中阴、阳极产生的气体物质的量之比为3:1 | |
| C. | 阴极的电极反应式为:2H2O+2e-═H2↑+2OH- | |
| D. | 阳极的电极反应式为:CO(NH2)2-6e-+8 OH-═CO32-+N2↑+6H2O |
| A. | 1mol Fe与足量氯气反应时转移的电子数为2NA | |
| B. | 标准状况下,2.24LCCl4的分子总数为0.1NA | |
| C. | 常温常压下,14g丙烯与环丙烷的混合气体,含碳原子总数为NA | |
| D. | 0.1mol/L CH3COONa溶液中含有的CH3COOH和CH3COO-总数为0.1NA |
| A. | 已知电离常数H2SO3 K1=1.3×10-2 K2=6.3×10-8;H2CO3 K1=4.2×10-7 K2=5.6×10-11.H2SO3溶液和NaHCO3溶液反应:H2SO3+2HCO3-═SO32-+2CO2↑+2H2O | |
| B. | 控制pH为9~10,用NaClO溶液将含NaCN的废水中的CN-氧化为两种无污染的气体:2CN-+5ClO-+2H+═N2↑+2CO2↑+5Cl-+H2O | |
| C. | 已知硫酸铅难溶于水,也难溶于硝酸,却可溶于醋酸铵溶液中,形成无色溶液.当Pb(CH3COO)2溶液中通入H2S气体时有黑色沉淀生成:Pb2++H2S═PbS↓+2H+ | |
| D. | CuSO4溶液与过量浓氨水反应:Cu2++4NH3•H2O═[Cu(NH3)4]2++4H2O |
①蒸发操作时,应使混合物中的水分完全蒸干后,才能停止加热
②过滤操作中,不能用玻璃棒搅拌加快过滤速度
③分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出
④萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大.
| A. | ②③ | B. | ①③ | C. | ①② | D. | ①④ |
| A. | 密闭容器中9.6克硫粉与11.2克铁粉混合加热生成硫化亚铁17.6克时放出19.12 kJ热量,则Fe(S)+S(S)=FeS(S)△H=-95.6 kJ•mol-1 | |
| B. | 稀醋酸和0.1mol/L的氢氧化钠溶液反应,H+(aq)+OH-(aq)=H2O(l)△H=-57.3kJ/mol | |
| C. | 已知1 mol氢气完全燃烧生成液态水所放出的热量为285.5 kJ,则水分解的热化学方程式:2H2O(l)=2H2(g)+O2(g)△H=+285.5kJ/mol | |
| D. | 已知2C(s)+O2(g)=2CO(g)△H=-221 kJ/mol,则可知C的燃烧热△H=-110.5 kJ/mol |
 名称是1,3-二甲基-2-丁烯
名称是1,3-二甲基-2-丁烯