题目内容
13.下列离子方程式书写正确的是( )| A. | 已知电离常数H2SO3 K1=1.3×10-2 K2=6.3×10-8;H2CO3 K1=4.2×10-7 K2=5.6×10-11.H2SO3溶液和NaHCO3溶液反应:H2SO3+2HCO3-═SO32-+2CO2↑+2H2O | |
| B. | 控制pH为9~10,用NaClO溶液将含NaCN的废水中的CN-氧化为两种无污染的气体:2CN-+5ClO-+2H+═N2↑+2CO2↑+5Cl-+H2O | |
| C. | 已知硫酸铅难溶于水,也难溶于硝酸,却可溶于醋酸铵溶液中,形成无色溶液.当Pb(CH3COO)2溶液中通入H2S气体时有黑色沉淀生成:Pb2++H2S═PbS↓+2H+ | |
| D. | CuSO4溶液与过量浓氨水反应:Cu2++4NH3•H2O═[Cu(NH3)4]2++4H2O |
分析 A.依据电离常数判断酸性强弱,依据强酸制备弱酸规律解答;
B.控制pH为9~10,为碱性环境,离子方程式的反应物中不能存在氢离子;
C.硫酸铅能够溶于醋酸铵,说明反应生成了弱电解质醋酸铅,醋酸铅在离子方程式中不能拆开;
D.氢氧化铜能够与一水合氨反应生成[Cu(NH3)4]2+.
解答 解:A.电离常数H2SO3 K1=1.3×10-2 K2=6.3×10-8;H2CO3 K1=4.2×10-7 K2=5.6×10-11.,可知碳酸酸性强于亚硫酸氢根,依据强酸制备弱酸规律,H2SO3+2HCO3-═SO32-+2CO2↑+2H2O不能发生,故A错误;
B.控制pH为9~10,用NaClO溶液将含NaCN的废水中的CN-氧化为两种无污染的气体,正确的离子方程式为:2CN-+5ClO-+H2O=N2↑+2CO2↑+5Cl-+2OH-,故B错误;
C.硫酸铅可溶于醋酸铵溶液中,形成无色溶液,说明醋酸铅为弱电解质,醋酸铅不能拆开,正确的反应为:(CH3COO)2Pb+H2S=PbS↓+2CH3COOH,故C错误;
D.CuSO4溶液与过量浓氨水反应,反应的离子方程式为:Cu2++4NH3•H2O=[Cu(NH3)4]2++4H2O,故D正确;
故选:D.
点评 本题考查了离子方程式的书写判断,题目难度中等,试题知识点较多、题量较大,充分考查学生灵活应用基础知识的能力,注意熟练掌握离子共存的条件、离子方程式的书写原则.

练习册系列答案
相关题目
18.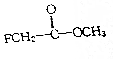 氟乙酸甲酚属于剧毒化工品,接触不慎有致命危险,氟乙酸甲酚的结构简式如图所示,下列说法不正确的是( )
氟乙酸甲酚属于剧毒化工品,接触不慎有致命危险,氟乙酸甲酚的结构简式如图所示,下列说法不正确的是( )
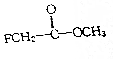 氟乙酸甲酚属于剧毒化工品,接触不慎有致命危险,氟乙酸甲酚的结构简式如图所示,下列说法不正确的是( )
氟乙酸甲酚属于剧毒化工品,接触不慎有致命危险,氟乙酸甲酚的结构简式如图所示,下列说法不正确的是( )| A. | 它含有两种官能团 | B. | 它属于卤代烃 | ||
| C. | 它能发生水解反应 | D. | 它属于烃的衍生物. |
1.研究人员研制利用低品位软锰矿浆(主要成分是MnO2)吸收硫酸厂的尾气SO2,制备硫酸锰的生产流程如图1:

已知:浸出液的pH<2,其中的金属离子主要是Mn2+,还含有少量的Fe2+、Al3+、Ca2+、Pb2+等其他金属离子.PbO2的氧化性大于MnO2.
有关金属离子的半径、形成氢氧化物沉淀时的pH见下表,阳离子吸附剂吸附金属离子的效果见图2.
请回答下列问题:
(1)写出浸出过程中生成Mn2+反应的化学方程式SO2+MnO2=MnSO4.
(2)氧化过程中主要反应的离子方程式2Fe2++MnO2+4H+=2Fe3++Mn2++2H2O.
(3)在氧化后的液体中加入石灰浆,用于调节pH值,此处调节pH值用到的仪器是pH计,应调节至4.7≤pH<8.3范围.
(4)阳离子吸附剂可用于除去杂质金属离子.请依据图、表信息回答,决定阳离子吸附剂吸附效果的因素有吸附时间、金属离子半径、金属离子电荷等;吸附步骤除去的主要离子为:Pb2+、Ca2+.
(5)CaSO4是一种微溶物质,已知Ksp(CaSO4)=9.10×10-7.现将c mol•L-1 CaCl2溶液与2.00×10-2mol•L-1 Na2SO4溶液等体积混合(忽略体积的变化),则生成沉淀时,c的最小值是1.82×10-5..

已知:浸出液的pH<2,其中的金属离子主要是Mn2+,还含有少量的Fe2+、Al3+、Ca2+、Pb2+等其他金属离子.PbO2的氧化性大于MnO2.
有关金属离子的半径、形成氢氧化物沉淀时的pH见下表,阳离子吸附剂吸附金属离子的效果见图2.
| 离子 | 离子半径(pm) | 开始沉淀 时的pH | 完全沉淀 时的pH |
| Fe2+ | 74 | 7.6 | 9.7 |
| Fe3+ | 64 | 2.7 | 3.7 |
| Al3+ | 50 | 3.8 | 4.7 |
| Mn2+ | 80 | 8.3 | 9.8 |
| Pb2+ | 121 | 8.0 | 8.8 |
| Ca2+ | 99 | - | - |
(1)写出浸出过程中生成Mn2+反应的化学方程式SO2+MnO2=MnSO4.
(2)氧化过程中主要反应的离子方程式2Fe2++MnO2+4H+=2Fe3++Mn2++2H2O.
(3)在氧化后的液体中加入石灰浆,用于调节pH值,此处调节pH值用到的仪器是pH计,应调节至4.7≤pH<8.3范围.
(4)阳离子吸附剂可用于除去杂质金属离子.请依据图、表信息回答,决定阳离子吸附剂吸附效果的因素有吸附时间、金属离子半径、金属离子电荷等;吸附步骤除去的主要离子为:Pb2+、Ca2+.
(5)CaSO4是一种微溶物质,已知Ksp(CaSO4)=9.10×10-7.现将c mol•L-1 CaCl2溶液与2.00×10-2mol•L-1 Na2SO4溶液等体积混合(忽略体积的变化),则生成沉淀时,c的最小值是1.82×10-5..
8.硫酸亚铁晶体可用于色谱分析试剂,点滴分析铂、硒、亚硝酸盐等.某研究小组进行如下实验:
实验一:硫酸亚铁晶体的制取
某酸性FeSO4溶液中含有少量的SnSO4,为得到纯净的硫酸亚铁晶体(FeSO4•xH2O),可向溶液中通入H2S气体至饱和,然后用硫酸酸化至PH=2.过滤后,将所得滤液蒸发浓缩、冷却结晶、过滤洗涤,得到FeSO4•7H2O晶体.查询资料,得有关物质的数据如下表:
(1)FeSO4溶液呈酸性的原因用离子方程式表示为Fe2++2H2O?Fe(OH)2+2H+.
(2)检验制得的绿矾晶体中是否含有Fe3+,可选用的试剂为AC.
A.KSCN溶液 B.稀H2SO4 C.淀粉-KI溶液 D.KMnO4溶液
(3)通入H2S至饱和的目的是除去溶液中的Sn2+离子,并防止Fe2+被氧化; 在溶液中用硫酸酸化至PH=2的目的是防止Fe2+离子生成沉淀.
实验二:测定硫酸亚铁晶体中结晶水的数目
某兴趣小组同学称取ag硫酸亚铁晶体样品,按图1装置进行高温加热,使其完全分解(硫酸亚铁晶体在高温条件下分解为三种化合物和一种单质,该单质能使带火星的木条复燃),对所得产物进行探究,并通过称量装置B质量测出x的值.
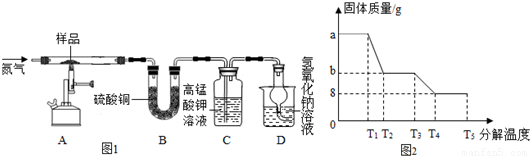
(4)装置B中无水硫酸铜粉末变蓝,质量增加12.6g,说明产物中有水,装置C中高锰酸钾溶液褪色,说明产物中还有二氧化硫.
(5)实验中要持续通入氮气,否则测出的x会偏小(填“偏大”、“偏小”或“不变”).
(6)硫酸亚铁晶体完全分解后装置A中固体呈红棕色,将其加入足量稀盐酸中,固体全部溶解,得黄色溶液,则红棕色固体是Fe2O3(填化学式).
(7)某研究所利用SDTQ600热分析仪对硫酸亚铁晶体进行热分解,获得相关数据,绘制成固体质量--分解温度的关系图如图2,根据图2中有关数据,可计算出x为7.7.
实验一:硫酸亚铁晶体的制取
某酸性FeSO4溶液中含有少量的SnSO4,为得到纯净的硫酸亚铁晶体(FeSO4•xH2O),可向溶液中通入H2S气体至饱和,然后用硫酸酸化至PH=2.过滤后,将所得滤液蒸发浓缩、冷却结晶、过滤洗涤,得到FeSO4•7H2O晶体.查询资料,得有关物质的数据如下表:
| 25℃ | pH | 25℃ | pH |
| 饱和H2S溶液 | 3.9 | FeS开始沉淀 | 3.0 |
| SnS沉淀完全 | 1.5 | FeS沉淀完全 | 5.5 |
(2)检验制得的绿矾晶体中是否含有Fe3+,可选用的试剂为AC.
A.KSCN溶液 B.稀H2SO4 C.淀粉-KI溶液 D.KMnO4溶液
(3)通入H2S至饱和的目的是除去溶液中的Sn2+离子,并防止Fe2+被氧化; 在溶液中用硫酸酸化至PH=2的目的是防止Fe2+离子生成沉淀.
实验二:测定硫酸亚铁晶体中结晶水的数目
某兴趣小组同学称取ag硫酸亚铁晶体样品,按图1装置进行高温加热,使其完全分解(硫酸亚铁晶体在高温条件下分解为三种化合物和一种单质,该单质能使带火星的木条复燃),对所得产物进行探究,并通过称量装置B质量测出x的值.

(4)装置B中无水硫酸铜粉末变蓝,质量增加12.6g,说明产物中有水,装置C中高锰酸钾溶液褪色,说明产物中还有二氧化硫.
(5)实验中要持续通入氮气,否则测出的x会偏小(填“偏大”、“偏小”或“不变”).
(6)硫酸亚铁晶体完全分解后装置A中固体呈红棕色,将其加入足量稀盐酸中,固体全部溶解,得黄色溶液,则红棕色固体是Fe2O3(填化学式).
(7)某研究所利用SDTQ600热分析仪对硫酸亚铁晶体进行热分解,获得相关数据,绘制成固体质量--分解温度的关系图如图2,根据图2中有关数据,可计算出x为7.7.
18.下列说法正确的是( )
| A. | 氢键、分子间作用力、离子键、共价键都是微粒间的作用力,其中氢键、离子键和共价键是化学键 | |
| B. | 石墨烯是一种从石墨材料中用“撕裂”方法剥离出的单层碳原子面材料,用这种方法从C60、金刚石等中获得“只有一层碳原子厚的碳薄片”也必将成为研究方向 | |
| C. | H、S、O三种元素组成的物质的水溶液与Na、S、O三种元素组成的物质的水溶液混合可能会观察到浑浊现象 | |
| D. | 测定中和热的实验中,应将酸、碱溶液一次性倒入量热装置中,并不断搅拌,待温度稳定后记下温度 |
5.下列离子方程式书写正确的是( )
| A. | 少量SO2通入Ca(ClO)2溶液中:SO2+H2O+Ca2++2ClO-═CaSO3↓+2HClO | |
| B. | Fe(NO3)3溶液中加人过量的HI溶液2Fe3++2I-═2Fe2++I2 | |
| C. | NaNO2溶液中加入酸性KMnO4溶液:2MnO4-+5NO2-+6H+═2Mn2++5NO3-+3H2O | |
| D. | NaHCO3溶液中加入过量的Ba(OH)2溶液:2HCO3-+Ba-+2BaCO3↓+2HO+CO32- |
2.0.2mol 气态燃料B2H6在氧气中燃烧,生成固态三氧化二硼和气态水,放出406.6kJ的热量,又知:H2O (l )═H2O(g)△H=+44kJ•mol-1,则B2H6的燃烧热为( )
| A. | 2165 kJ•mol-1 | B. | 2033 kJ•mol-1 | C. | 406.6 kJ•mol-1 | D. | 2077 kJ•mol-1 |
3.关于如图所示装置的叙述,正确的是( )


| A. | 铜是阳极,铜片上有气泡产生 | B. | 溶液由无色逐渐变成蓝色 | ||
| C. | 电流由锌片流向铜片 | D. | 锌片被氧化 |
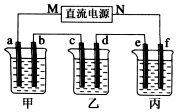 如图所示装置中,甲、乙、丙三个烧杯依次分别盛放100g 5.00%的NaOH溶液、足量的CuSO4溶液和100g 10.00%的K2SO4溶液,电极均为石墨电极.接通电源,经过t mim后,测得甲中NaOH浓度为6.097%,乙中d电极质量增加.据此回答问题:
如图所示装置中,甲、乙、丙三个烧杯依次分别盛放100g 5.00%的NaOH溶液、足量的CuSO4溶液和100g 10.00%的K2SO4溶液,电极均为石墨电极.接通电源,经过t mim后,测得甲中NaOH浓度为6.097%,乙中d电极质量增加.据此回答问题: