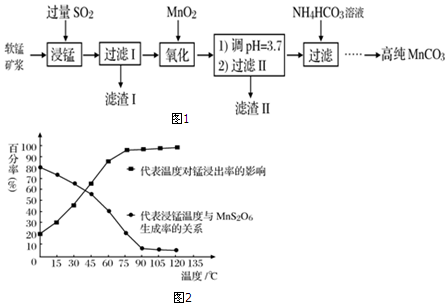
题目内容
12.在室温下进行中和滴定,酸和碱恰好完全反应时,以下说法一定正确的是( )| A. | 参加反应的酸和碱的物质的量相等 | |
| B. | 参加反应的酸中的H+总量和碱中的OH-总量相等 | |
| C. | 反应后混合液的pH=7 | |
| D. | 不能用适当的酸碱指示剂来判断 |
分析 中和滴定时,滴定终点酸碱恰好反应,则参加反应的酸中的H+总量和碱中的OH-总量相等,反应后溶液不一定为中性,取决于酸碱的强弱,以此解答该题.
解答 解:A.恰好完全反应时,参加反应的酸和碱的物质的是按方程式的计量数之比反应,参加反应的酸和碱的物质的量不一定相等,故A错误;
B.在室温下进行中和滴定,酸和碱恰好完全反应时,参加反应的酸中的H+离子总量和碱中OH-离子总量相等,故B正确;
C.温下酸和碱恰好完全反应时,溶液的pH不一定等于7,如醋酸与NaOH溶液的反应,恰好反应时生成醋酸钠,醋酸根离子部分水解,溶液呈碱性,故C错误;
D.根据反应后溶液的酸碱性,可确定不同的酸碱指示剂,如碱性溶液可用酚酞,酸性溶液用甲基橙,故D错误.
故选B.
点评 本题考查了中和滴定的操作方法,为高频考点,题目难度不大,明确酸碱恰好中和反应的含义为解答关键,注意熟练掌握中和滴定操作方法,试题培养了学生的分析能力及化学实验能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
2.在一定条件下,体积为10L的密闭容器中,1mol X和1mol Y进行反应:2X(g)+Y(g)?Z(g),经60s达到平衡,生成0.3mol Z,下列说法正确的是( )
| A. | 若增大压强,则物质Y的转化率减小 | |
| B. | 以X浓度变化表示的反应速率为0.001 mol/(L•s) | |
| C. | 若升高温度,X的体积分数增大,则该反应的△H>0 | |
| D. | 将容器体积变为20 L,Z的平衡浓度变为原来的1/2 |
3.下列物质属于电解质的是( )
| A. | 石墨 | B. | 液态HCl | C. | 葡萄糖 | D. | Na2CO3溶液 |
20.若要将0.6mol甲烷完全和氯气发生取代反应,并且生成相同物质的量的四种取代物,则需要氯气的物质的量为( )
| A. | 2.5mol | B. | 4.5mol | C. | 1.5mol | D. | 0.6mol |
4.为除去括号内的杂质,下列所选用试剂和方法均正确的是( )
| A. | Na2CO3溶液(NaHCO3),加热 | |
| B. | 铁粉(铝粉):加入过量的氨水后过滤 | |
| C. | NaCl溶液(Na2SO4):加入适量的硝酸钡后过滤 | |
| D. | 淀粉溶液(KCl):通过半透膜进行渗析 |
8.硫酸亚铁晶体可用于色谱分析试剂,点滴分析铂、硒、亚硝酸盐等.某研究小组进行如下实验:
实验一:硫酸亚铁晶体的制取
某酸性FeSO4溶液中含有少量的SnSO4,为得到纯净的硫酸亚铁晶体(FeSO4•xH2O),可向溶液中通入H2S气体至饱和,然后用硫酸酸化至PH=2.过滤后,将所得滤液蒸发浓缩、冷却结晶、过滤洗涤,得到FeSO4•7H2O晶体.查询资料,得有关物质的数据如下表:
(1)FeSO4溶液呈酸性的原因用离子方程式表示为Fe2++2H2O?Fe(OH)2+2H+.
(2)检验制得的绿矾晶体中是否含有Fe3+,可选用的试剂为AC.
A.KSCN溶液 B.稀H2SO4 C.淀粉-KI溶液 D.KMnO4溶液
(3)通入H2S至饱和的目的是除去溶液中的Sn2+离子,并防止Fe2+被氧化; 在溶液中用硫酸酸化至PH=2的目的是防止Fe2+离子生成沉淀.
实验二:测定硫酸亚铁晶体中结晶水的数目
某兴趣小组同学称取ag硫酸亚铁晶体样品,按图1装置进行高温加热,使其完全分解(硫酸亚铁晶体在高温条件下分解为三种化合物和一种单质,该单质能使带火星的木条复燃),对所得产物进行探究,并通过称量装置B质量测出x的值.
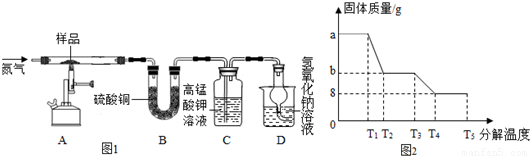
(4)装置B中无水硫酸铜粉末变蓝,质量增加12.6g,说明产物中有水,装置C中高锰酸钾溶液褪色,说明产物中还有二氧化硫.
(5)实验中要持续通入氮气,否则测出的x会偏小(填“偏大”、“偏小”或“不变”).
(6)硫酸亚铁晶体完全分解后装置A中固体呈红棕色,将其加入足量稀盐酸中,固体全部溶解,得黄色溶液,则红棕色固体是Fe2O3(填化学式).
(7)某研究所利用SDTQ600热分析仪对硫酸亚铁晶体进行热分解,获得相关数据,绘制成固体质量--分解温度的关系图如图2,根据图2中有关数据,可计算出x为7.7.
实验一:硫酸亚铁晶体的制取
某酸性FeSO4溶液中含有少量的SnSO4,为得到纯净的硫酸亚铁晶体(FeSO4•xH2O),可向溶液中通入H2S气体至饱和,然后用硫酸酸化至PH=2.过滤后,将所得滤液蒸发浓缩、冷却结晶、过滤洗涤,得到FeSO4•7H2O晶体.查询资料,得有关物质的数据如下表:
| 25℃ | pH | 25℃ | pH |
| 饱和H2S溶液 | 3.9 | FeS开始沉淀 | 3.0 |
| SnS沉淀完全 | 1.5 | FeS沉淀完全 | 5.5 |
(2)检验制得的绿矾晶体中是否含有Fe3+,可选用的试剂为AC.
A.KSCN溶液 B.稀H2SO4 C.淀粉-KI溶液 D.KMnO4溶液
(3)通入H2S至饱和的目的是除去溶液中的Sn2+离子,并防止Fe2+被氧化; 在溶液中用硫酸酸化至PH=2的目的是防止Fe2+离子生成沉淀.
实验二:测定硫酸亚铁晶体中结晶水的数目
某兴趣小组同学称取ag硫酸亚铁晶体样品,按图1装置进行高温加热,使其完全分解(硫酸亚铁晶体在高温条件下分解为三种化合物和一种单质,该单质能使带火星的木条复燃),对所得产物进行探究,并通过称量装置B质量测出x的值.

(4)装置B中无水硫酸铜粉末变蓝,质量增加12.6g,说明产物中有水,装置C中高锰酸钾溶液褪色,说明产物中还有二氧化硫.
(5)实验中要持续通入氮气,否则测出的x会偏小(填“偏大”、“偏小”或“不变”).
(6)硫酸亚铁晶体完全分解后装置A中固体呈红棕色,将其加入足量稀盐酸中,固体全部溶解,得黄色溶液,则红棕色固体是Fe2O3(填化学式).
(7)某研究所利用SDTQ600热分析仪对硫酸亚铁晶体进行热分解,获得相关数据,绘制成固体质量--分解温度的关系图如图2,根据图2中有关数据,可计算出x为7.7.
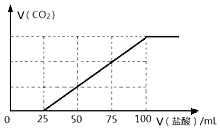 向100mLNaOH溶液中通入一定量的CO2气体,充分反应后,再向所得溶液中逐滴加入2.0mol/L的盐酸,产生CO2的体积与所加盐酸体积之间关系如图所示.
向100mLNaOH溶液中通入一定量的CO2气体,充分反应后,再向所得溶液中逐滴加入2.0mol/L的盐酸,产生CO2的体积与所加盐酸体积之间关系如图所示.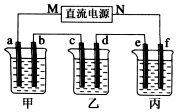 如图所示装置中,甲、乙、丙三个烧杯依次分别盛放100g 5.00%的NaOH溶液、足量的CuSO4溶液和100g 10.00%的K2SO4溶液,电极均为石墨电极.接通电源,经过t mim后,测得甲中NaOH浓度为6.097%,乙中d电极质量增加.据此回答问题:
如图所示装置中,甲、乙、丙三个烧杯依次分别盛放100g 5.00%的NaOH溶液、足量的CuSO4溶液和100g 10.00%的K2SO4溶液,电极均为石墨电极.接通电源,经过t mim后,测得甲中NaOH浓度为6.097%,乙中d电极质量增加.据此回答问题: