题目内容
10.设NA表示阿伏伽德罗常数的值.下列说法正确的是( )| A. | 1mol Fe与足量氯气反应时转移的电子数为2NA | |
| B. | 标准状况下,2.24LCCl4的分子总数为0.1NA | |
| C. | 常温常压下,14g丙烯与环丙烷的混合气体,含碳原子总数为NA | |
| D. | 0.1mol/L CH3COONa溶液中含有的CH3COOH和CH3COO-总数为0.1NA |
分析 A、铁和氯气反应后变为+3价;
B、标况下四氯化碳为液体;
C、丙烯和环丙烷的最简式均为CH2;
D、溶液体积不明确.
解答 解:A、铁和氯气反应后变为+3价,故1mol铁反应后转移3NA个电子,故A错误;
B、标况下四氯化碳为液体,故不能根据气体摩尔体积来计算其物质的量和分子个数,故B错误;
C、丙烯和环丙烷的最简式均为CH2,故14g两者的混合物中含有的CH2的物质的量为1mol,故含NA个碳原子,故C正确;
D、溶液体积不明确,故溶液中的CH3COOH和CH3COO-总数无法计算,故D错误.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,难度不大,应注意掌握公式的运用和物质的结构.

练习册系列答案
 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案
相关题目
20.若要将0.6mol甲烷完全和氯气发生取代反应,并且生成相同物质的量的四种取代物,则需要氯气的物质的量为( )
| A. | 2.5mol | B. | 4.5mol | C. | 1.5mol | D. | 0.6mol |
18.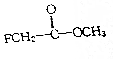 氟乙酸甲酚属于剧毒化工品,接触不慎有致命危险,氟乙酸甲酚的结构简式如图所示,下列说法不正确的是( )
氟乙酸甲酚属于剧毒化工品,接触不慎有致命危险,氟乙酸甲酚的结构简式如图所示,下列说法不正确的是( )
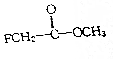 氟乙酸甲酚属于剧毒化工品,接触不慎有致命危险,氟乙酸甲酚的结构简式如图所示,下列说法不正确的是( )
氟乙酸甲酚属于剧毒化工品,接触不慎有致命危险,氟乙酸甲酚的结构简式如图所示,下列说法不正确的是( )| A. | 它含有两种官能团 | B. | 它属于卤代烃 | ||
| C. | 它能发生水解反应 | D. | 它属于烃的衍生物. |
5.将0.08mol的M、N(N的相对分子质量大于M)两种饱和一元醛的混合物,与足量的新制氢氧化铜悬浊液共热,可生成14.4g砖红色沉淀,下列说法正确的是( )
| A. | M可能是甲醛,也可能是乙醛 | |
| B. | 混合物中必有乙醛,其物质的量为0.06mol | |
| C. | 不能判断出N是何种醛,但其物质的量是0.06mol | |
| D. | M一定是甲醛,N一定是丙醛,其物质的量之比为1:3 |
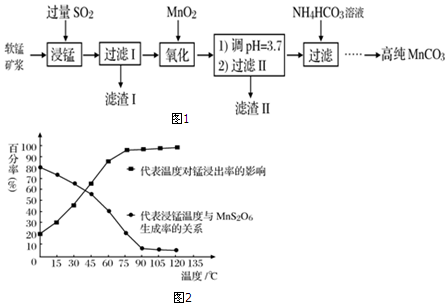
1.研究人员研制利用低品位软锰矿浆(主要成分是MnO2)吸收硫酸厂的尾气SO2,制备硫酸锰的生产流程如图1:

已知:浸出液的pH<2,其中的金属离子主要是Mn2+,还含有少量的Fe2+、Al3+、Ca2+、Pb2+等其他金属离子.PbO2的氧化性大于MnO2.
有关金属离子的半径、形成氢氧化物沉淀时的pH见下表,阳离子吸附剂吸附金属离子的效果见图2.
请回答下列问题:
(1)写出浸出过程中生成Mn2+反应的化学方程式SO2+MnO2=MnSO4.
(2)氧化过程中主要反应的离子方程式2Fe2++MnO2+4H+=2Fe3++Mn2++2H2O.
(3)在氧化后的液体中加入石灰浆,用于调节pH值,此处调节pH值用到的仪器是pH计,应调节至4.7≤pH<8.3范围.
(4)阳离子吸附剂可用于除去杂质金属离子.请依据图、表信息回答,决定阳离子吸附剂吸附效果的因素有吸附时间、金属离子半径、金属离子电荷等;吸附步骤除去的主要离子为:Pb2+、Ca2+.
(5)CaSO4是一种微溶物质,已知Ksp(CaSO4)=9.10×10-7.现将c mol•L-1 CaCl2溶液与2.00×10-2mol•L-1 Na2SO4溶液等体积混合(忽略体积的变化),则生成沉淀时,c的最小值是1.82×10-5..

已知:浸出液的pH<2,其中的金属离子主要是Mn2+,还含有少量的Fe2+、Al3+、Ca2+、Pb2+等其他金属离子.PbO2的氧化性大于MnO2.
有关金属离子的半径、形成氢氧化物沉淀时的pH见下表,阳离子吸附剂吸附金属离子的效果见图2.
| 离子 | 离子半径(pm) | 开始沉淀 时的pH | 完全沉淀 时的pH |
| Fe2+ | 74 | 7.6 | 9.7 |
| Fe3+ | 64 | 2.7 | 3.7 |
| Al3+ | 50 | 3.8 | 4.7 |
| Mn2+ | 80 | 8.3 | 9.8 |
| Pb2+ | 121 | 8.0 | 8.8 |
| Ca2+ | 99 | - | - |
(1)写出浸出过程中生成Mn2+反应的化学方程式SO2+MnO2=MnSO4.
(2)氧化过程中主要反应的离子方程式2Fe2++MnO2+4H+=2Fe3++Mn2++2H2O.
(3)在氧化后的液体中加入石灰浆,用于调节pH值,此处调节pH值用到的仪器是pH计,应调节至4.7≤pH<8.3范围.
(4)阳离子吸附剂可用于除去杂质金属离子.请依据图、表信息回答,决定阳离子吸附剂吸附效果的因素有吸附时间、金属离子半径、金属离子电荷等;吸附步骤除去的主要离子为:Pb2+、Ca2+.
(5)CaSO4是一种微溶物质,已知Ksp(CaSO4)=9.10×10-7.现将c mol•L-1 CaCl2溶液与2.00×10-2mol•L-1 Na2SO4溶液等体积混合(忽略体积的变化),则生成沉淀时,c的最小值是1.82×10-5..
8.硫酸亚铁晶体可用于色谱分析试剂,点滴分析铂、硒、亚硝酸盐等.某研究小组进行如下实验:
实验一:硫酸亚铁晶体的制取
某酸性FeSO4溶液中含有少量的SnSO4,为得到纯净的硫酸亚铁晶体(FeSO4•xH2O),可向溶液中通入H2S气体至饱和,然后用硫酸酸化至PH=2.过滤后,将所得滤液蒸发浓缩、冷却结晶、过滤洗涤,得到FeSO4•7H2O晶体.查询资料,得有关物质的数据如下表:
(1)FeSO4溶液呈酸性的原因用离子方程式表示为Fe2++2H2O?Fe(OH)2+2H+.
(2)检验制得的绿矾晶体中是否含有Fe3+,可选用的试剂为AC.
A.KSCN溶液 B.稀H2SO4 C.淀粉-KI溶液 D.KMnO4溶液
(3)通入H2S至饱和的目的是除去溶液中的Sn2+离子,并防止Fe2+被氧化; 在溶液中用硫酸酸化至PH=2的目的是防止Fe2+离子生成沉淀.
实验二:测定硫酸亚铁晶体中结晶水的数目
某兴趣小组同学称取ag硫酸亚铁晶体样品,按图1装置进行高温加热,使其完全分解(硫酸亚铁晶体在高温条件下分解为三种化合物和一种单质,该单质能使带火星的木条复燃),对所得产物进行探究,并通过称量装置B质量测出x的值.
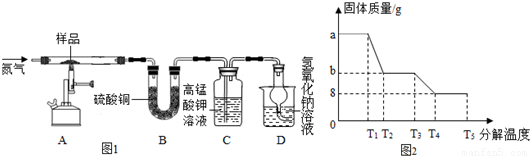
(4)装置B中无水硫酸铜粉末变蓝,质量增加12.6g,说明产物中有水,装置C中高锰酸钾溶液褪色,说明产物中还有二氧化硫.
(5)实验中要持续通入氮气,否则测出的x会偏小(填“偏大”、“偏小”或“不变”).
(6)硫酸亚铁晶体完全分解后装置A中固体呈红棕色,将其加入足量稀盐酸中,固体全部溶解,得黄色溶液,则红棕色固体是Fe2O3(填化学式).
(7)某研究所利用SDTQ600热分析仪对硫酸亚铁晶体进行热分解,获得相关数据,绘制成固体质量--分解温度的关系图如图2,根据图2中有关数据,可计算出x为7.7.
实验一:硫酸亚铁晶体的制取
某酸性FeSO4溶液中含有少量的SnSO4,为得到纯净的硫酸亚铁晶体(FeSO4•xH2O),可向溶液中通入H2S气体至饱和,然后用硫酸酸化至PH=2.过滤后,将所得滤液蒸发浓缩、冷却结晶、过滤洗涤,得到FeSO4•7H2O晶体.查询资料,得有关物质的数据如下表:
| 25℃ | pH | 25℃ | pH |
| 饱和H2S溶液 | 3.9 | FeS开始沉淀 | 3.0 |
| SnS沉淀完全 | 1.5 | FeS沉淀完全 | 5.5 |
(2)检验制得的绿矾晶体中是否含有Fe3+,可选用的试剂为AC.
A.KSCN溶液 B.稀H2SO4 C.淀粉-KI溶液 D.KMnO4溶液
(3)通入H2S至饱和的目的是除去溶液中的Sn2+离子,并防止Fe2+被氧化; 在溶液中用硫酸酸化至PH=2的目的是防止Fe2+离子生成沉淀.
实验二:测定硫酸亚铁晶体中结晶水的数目
某兴趣小组同学称取ag硫酸亚铁晶体样品,按图1装置进行高温加热,使其完全分解(硫酸亚铁晶体在高温条件下分解为三种化合物和一种单质,该单质能使带火星的木条复燃),对所得产物进行探究,并通过称量装置B质量测出x的值.

(4)装置B中无水硫酸铜粉末变蓝,质量增加12.6g,说明产物中有水,装置C中高锰酸钾溶液褪色,说明产物中还有二氧化硫.
(5)实验中要持续通入氮气,否则测出的x会偏小(填“偏大”、“偏小”或“不变”).
(6)硫酸亚铁晶体完全分解后装置A中固体呈红棕色,将其加入足量稀盐酸中,固体全部溶解,得黄色溶液,则红棕色固体是Fe2O3(填化学式).
(7)某研究所利用SDTQ600热分析仪对硫酸亚铁晶体进行热分解,获得相关数据,绘制成固体质量--分解温度的关系图如图2,根据图2中有关数据,可计算出x为7.7.
5.下列离子方程式书写正确的是( )
| A. | 少量SO2通入Ca(ClO)2溶液中:SO2+H2O+Ca2++2ClO-═CaSO3↓+2HClO | |
| B. | Fe(NO3)3溶液中加人过量的HI溶液2Fe3++2I-═2Fe2++I2 | |
| C. | NaNO2溶液中加入酸性KMnO4溶液:2MnO4-+5NO2-+6H+═2Mn2++5NO3-+3H2O | |
| D. | NaHCO3溶液中加入过量的Ba(OH)2溶液:2HCO3-+Ba-+2BaCO3↓+2HO+CO32- |
6.下列有机物命名正确的是( )
| A. | 2-乙基丁烷 | B. | 2-乙基-1-丁烯 | C. | 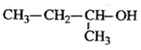 2-甲基-1-丙醇 | D. | 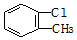 间氯甲苯 间氯甲苯 |