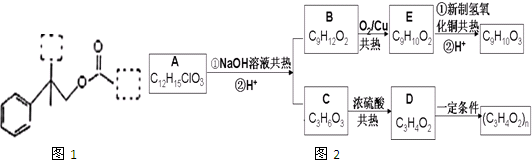
题目内容
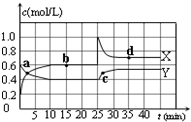 已知:2NO2(g)?N2O4(g);△H<0.在恒温恒容条件下,将一定量NO2和N2O4的混合气体通入容积为2L的密闭容器中,反应过程中各物质的物质的量浓度c随时间t的变化关系如图所示.
已知:2NO2(g)?N2O4(g);△H<0.在恒温恒容条件下,将一定量NO2和N2O4的混合气体通入容积为2L的密闭容器中,反应过程中各物质的物质的量浓度c随时间t的变化关系如图所示.(1)如图中a、b、c、d四个点中,表示化学反应处于平衡状态的点是
(2)前10min内用NO2表示的化学反应速率v(NO2)=
考点:化学平衡建立的过程,化学平衡的影响因素
专题:
分析:由图可知10-25min平衡状态时,X表示的生成物的浓度变化量为(0.6-0.2)mol/L=0.4mol/L,Y表示的反应物的浓度变化量为(0.6-0.4)mol/L=0.2mol/L,X表示的生成物的浓度变化量是Y表示的反应物的浓度变化量的2倍,所以X表示NO2浓度随时间的变化曲线,Y表示N2O4浓度随时间的变化曲线,
①根据图象及物质的浓度不发生变化时表示化学反应处于平衡状态;
②根据v=
求得速率,根据影响平衡常数的因素可比较出K(2)、K(1)的大小.
①根据图象及物质的浓度不发生变化时表示化学反应处于平衡状态;
②根据v=
| △c |
| △t |
解答:
解:(1)由图可知10-25min平衡状态时,X表示的生成物的浓度变化量为(0.6-0.2)mol/L=0.4mol/L,Y表示的反应物的浓度变化量为(0.6-0.4)mol/L=0.2mol/L,X表示的生成物的浓度变化量是Y表示的反应物的浓度变化量的2倍,所以X表示NO2浓度随时间的变化曲线,Y表示N2O4浓度随时间的变化曲线;
①由图可知,10-25min及35min之后X、Y的物质的量不发生变化,则相应时间段内的点处于化学平衡状态,即b、d处于化学平衡状态,故答案为:bd;
②由图可知,前10min内用NO2的物质的量浓度变化了0.4mol/L,故化学反应速率v(NO2)=
=0.04mol?L-1?min-1,
由于平衡常数只与温度有关,所以当温度不变时,平衡常数不变,故答案为:0.04mol?L-1?min-1;=.
①由图可知,10-25min及35min之后X、Y的物质的量不发生变化,则相应时间段内的点处于化学平衡状态,即b、d处于化学平衡状态,故答案为:bd;
②由图可知,前10min内用NO2的物质的量浓度变化了0.4mol/L,故化学反应速率v(NO2)=
| 0.4mol/L |
| 10min |
由于平衡常数只与温度有关,所以当温度不变时,平衡常数不变,故答案为:0.04mol?L-1?min-1;=.
点评:本题考查了平衡状态的判断、反应速率的计算、影响平衡常数的因素等知识,题目难度不大,本题注意从图象判断各种氢化物的种类为解答该题的关键.

练习册系列答案
相关题目
下列叙述中正确的是( )
| A、Al、Fe、Cu三者对应的氧化物均为碱性氧化物 |
| B、Fe3+有氧化性,所以可以用FeCl3溶液来回收旧电路板中的铜 |
| C、向NaAlO2溶液中通入过量CO2:2AlO2-+CO2+3H2O═2Al(OH)3↓+CO32- |
| D、加入铝粉能产生H2的溶液中,一定存在大量的Na+、Ba2+、AlO2-、Cl- |
水溶液中能大量共存的一组离子是( )
| A、Na+、Ca2+、Cl-、SO42- |
| B、Mg2+、NH4+、Cl-、SO42- |
| C、Fe2+、H+、SO32-、ClO- |
| D、K+、Fe3+、NO3-、SCN- |
下列物质熔点比较错误的( )
| A、Na<Mg<Al |
| B、Br2<Cl2<I2 |
| C、硅<碳化硅<金刚石 |
| D、AlCl3<KCl<NaCl |
设NA为阿伏加德罗常数,下列叙述中,正确的是( )
| A、标准状况下,NH3和CH4的混合气体2.24L,所含电子总数为2NA |
| B、7g CnH2n中含氢原子数为NA |
| C、78 g 过氧化钠与CO2反应,转移电子数为2NA |
| D、25℃时,0.1mol/L的NaOH溶液中,含有钠离子数为0.1NA |
在一密闭容器中加入一定物质的量的A气体,发生 a A(g)?b B(g)+c C(g)反应,达平衡后,保持温度不变,将容器体积扩大为原来的一倍,当达到新的平衡时c(A)变为原平衡的40%,下列说法正确的是( )
| A、化学计量数之间的关系:a>b+c |
| B、物质B的体积分数减小 |
| C、平衡向正反应方向移动 |
| D、平衡移动过程中,与原平衡相比v正增大、v逆减小 |
某粒子的结构示意图为  该粒子的说法不正确的是( )
该粒子的说法不正确的是( )
 该粒子的说法不正确的是( )
该粒子的说法不正确的是( )| A、核电荷数为9 |
| B、核外有两个电子层 |
| C、属于阴离子 |
| D、在化学反应中容易得到1个电子 |