题目内容
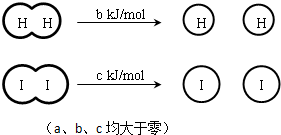
H2和I2在一定条件下能发生反应:H2(g)+I2(g)═2HI(g)△H=-a kJ/mol下列说法正确的是( )
已知:
已知:

| A、H2、I2和HI分子中的化学键都是非极性共价键 |
| B、断开2 mol HI分子中的化学键所需能量约为(c+b+a) kJ |
| C、相同条件下,1 mol H2(g)和1mol I2(g)总能量小于2 mol HI (g)的总能量 |
| D、向密闭容器中加入2 mol H2(g)和2 mol I2(g),充分反应后放出的热量为2a kJ |
考点:反应热和焓变
专题:化学反应中的能量变化
分析:A、HI分子中的化学键是极性共价键;
B、依据焓变=反应物断裂化学键需要的能量-生成物形成化学键放出的能量分析判断;
C、依据反应是放热反应,结合能量守恒分析;
D、反应是可逆反应不能进行彻底.
B、依据焓变=反应物断裂化学键需要的能量-生成物形成化学键放出的能量分析判断;
C、依据反应是放热反应,结合能量守恒分析;
D、反应是可逆反应不能进行彻底.
解答:
解:A、HI分子中的化学键是极性共价键,故A错误;
B、△H=反应物断裂化学键需要的能量-生成物形成化学键放出的能量=bKJ/mol+cKJ/mol-2H-I=-aKJ/mol,得到断开2mol H-I键所需能量约为(a+b+c)KJ,故B正确;
C、H2和I2在一定条件下能发生反应:H2(g)+I2(g)?2HI(g)△H=-a kJ?mol-1 ,反应是放热反应,反应物能量高于生成物,故C错误;
D、反应是可逆反应不能进行彻底,依据焓变意义分析,向密闭容器中加入2mol H2和2mol I2,充分反应后放出的热量小于2a kJ,故D错误;
故选B.
B、△H=反应物断裂化学键需要的能量-生成物形成化学键放出的能量=bKJ/mol+cKJ/mol-2H-I=-aKJ/mol,得到断开2mol H-I键所需能量约为(a+b+c)KJ,故B正确;
C、H2和I2在一定条件下能发生反应:H2(g)+I2(g)?2HI(g)△H=-a kJ?mol-1 ,反应是放热反应,反应物能量高于生成物,故C错误;
D、反应是可逆反应不能进行彻底,依据焓变意义分析,向密闭容器中加入2mol H2和2mol I2,充分反应后放出的热量小于2a kJ,故D错误;
故选B.
点评:本题考查了化学反应的焓变分析,化学键与焓变关系的计算分析应用,掌握原理和基础是解题关键,题目难度中等.

练习册系列答案
相关题目
下列各组离子在溶液中能大量共存的是( )
| A、Na+、Al3+、NO3-、H+ |
| B、Ba2+、Na+、Cl-、SO42- |
| C、Mg2+、H+、SO42-、OH- |
| D、H+、Na+、CO32-、Cl- |
下列反应是制取某一种香料的中间过程: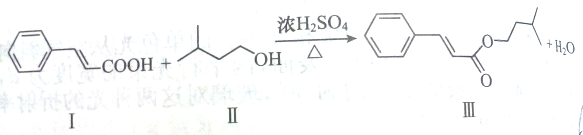
下列有关说法正确的是( )

下列有关说法正确的是( )
| A、Ⅱ物质的名称为2-甲基-4-丁醇 |
| B、Ⅲ物质的分子式为C14H18O2 |
| C、Ⅰ物质的9个碳原子一定共面 |
| D、Ⅲ物质中有3种官能团 |
下列说法正确的是( )
| A、浓硫酸有吸水性,可用于干燥氨气 |
| B、SiO2是酸性氧化物,能与NaOH溶液反应 |
| C、Na2O2与水反应、红热的Fe与水蒸气反应均能生成碱 |
| D、新制氯水显酸性,滴加少量紫色石蕊溶液,溶液始终呈红色 |
 H2S是一种无色、有毒的可燃性气体,其水溶液叫氢硫酸(二元弱酸).
H2S是一种无色、有毒的可燃性气体,其水溶液叫氢硫酸(二元弱酸).