题目内容
材料是人类赖以生存和发展的重要物质基础.
①在下列材料中,属于有机高分子材料的是 ;属于复合材料的是 .
a.硬币 b.聚氯乙烯塑料 c.氮化硅陶瓷 d.玻璃钢
②硅酸盐水泥是常用的建筑材料,它主要是以 和黏土为原料制成.
③钢铁在潮湿的空气中主要发生的电化学腐蚀是 腐蚀,通常用钝化、涂漆、电镀等方法来防止腐蚀.
①在下列材料中,属于有机高分子材料的是
a.硬币 b.聚氯乙烯塑料 c.氮化硅陶瓷 d.玻璃钢
②硅酸盐水泥是常用的建筑材料,它主要是以
③钢铁在潮湿的空气中主要发生的电化学腐蚀是
考点:合成材料,金属的电化学腐蚀与防护,无机非金属材料
专题:
分析:①有机高分子材料分为天然有机高分子材料和合成有机高分子材料.合成有机高分子材料简称合成材料;复合材料是指两种或两种以上的不同性能的材料,通过物理或化学的方法,组成的具有新性能的材料,可根据概念解答.
②制备水泥的原料是石灰石和粘土;
③钢铁的腐蚀可以根据水膜的性质分为吸氧腐蚀和析氢腐蚀.
②制备水泥的原料是石灰石和粘土;
③钢铁的腐蚀可以根据水膜的性质分为吸氧腐蚀和析氢腐蚀.
解答:
解:①a、硬币是合金,属于无机金属材料;
b、聚乙烯塑料是有机高分子材料;
c、氮化硅陶瓷是无机非金属材料;
d、玻璃钢是玻璃和纤维融合而成的复合材料,
故答案为:b;d;
②制备水泥的原料是石灰石和粘土,故答案为:石灰石;
③钢铁的腐蚀可以根据水膜的性质分为吸氧腐蚀和析氢腐蚀,当水膜酸性较强时,发生析氢腐蚀,当水膜呈弱酸性或中性时,发生吸氧腐蚀.钢铁的腐蚀以吸氧腐蚀为主,故答案为:吸氧.
b、聚乙烯塑料是有机高分子材料;
c、氮化硅陶瓷是无机非金属材料;
d、玻璃钢是玻璃和纤维融合而成的复合材料,
故答案为:b;d;
②制备水泥的原料是石灰石和粘土,故答案为:石灰石;
③钢铁的腐蚀可以根据水膜的性质分为吸氧腐蚀和析氢腐蚀,当水膜酸性较强时,发生析氢腐蚀,当水膜呈弱酸性或中性时,发生吸氧腐蚀.钢铁的腐蚀以吸氧腐蚀为主,故答案为:吸氧.
点评:本题考查了常用的材料的分类和制备水泥的原料以及钢铁的腐蚀,应注意的是钢铁的腐蚀以吸氧腐蚀为主.

练习册系列答案
相关题目
光导纤维的主要成分是( )
| A、Si |
| B、SiO2 |
| C、Na2SiO3 |
| D、SiCl4 |
H2和I2在一定条件下能发生反应:H2(g)+I2(g)═2HI(g)△H=-a kJ/mol下列说法正确的是( )
已知:
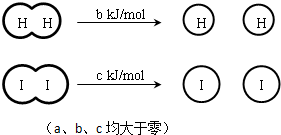
已知:

| A、H2、I2和HI分子中的化学键都是非极性共价键 |
| B、断开2 mol HI分子中的化学键所需能量约为(c+b+a) kJ |
| C、相同条件下,1 mol H2(g)和1mol I2(g)总能量小于2 mol HI (g)的总能量 |
| D、向密闭容器中加入2 mol H2(g)和2 mol I2(g),充分反应后放出的热量为2a kJ |
下列作用不属于水解反应的是( )
| A、吃馒头时多咀嚼后有甜味 |
| B、淀粉溶液和稀硫酸共热一段时间后,滴加碘水不显蓝色 |
| C、葡萄糖被氧化成二氧化碳与水 |
| D、油脂与氢氧化钠溶液共煮后制肥皂 |
能用于工业生产的是( )
| A、钠在氯气中燃烧制氯化钠 |
| B、二氧化锰和浓盐酸共热制氯气 |
| C、氯气与消石灰反应制漂白粉 |
| D、电解NaCl溶液制金属钠 |
已知下列反应的热化学方程式:
6C(s)+5H2(g)+3N2(g)+9O2(g)=2C3H5(ONO2)3(l)△H1
H2(g)+
O2(g)=H2O(g)△H2
C(s)+O2(g)=CO2(g)△H3
则反应4C3H5(ONO2)3(l)=12CO2(g)+10H2O(g)+O2(g)+6N2(g)的△H为( )
6C(s)+5H2(g)+3N2(g)+9O2(g)=2C3H5(ONO2)3(l)△H1
H2(g)+
| 1 |
| 2 |
C(s)+O2(g)=CO2(g)△H3
则反应4C3H5(ONO2)3(l)=12CO2(g)+10H2O(g)+O2(g)+6N2(g)的△H为( )
| A、12△H3+10△H2-2△H1 |
| B、2△H1-10△H2-12△H3 |
| C、12△H3-10△H2-2△H1 |
| D、△H1-10△H2-12△H3 |

 按要求回答下列问题:
按要求回答下列问题: