题目内容
16.某地有软锰矿和闪锌矿两座矿山,它们的组成(质量分数)如表:| 软锰矿 | 闪锌矿 |
| MnO2约70%,SiO2约20%,Al2O3约4%,其余为水分 | ZnS约80%,FeS、CuS、SiO2共约7%,其余为水分 |
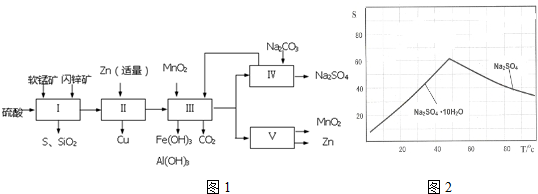
(1)流程Ⅰ所得滤液中含有MnSO4、ZnSO4、CuSO4、Fe2(SO4)3、Al2(SO4)3等,则流程Ⅰ中被氧化的物质有FeS、CuS种.
(2)流程Ⅱ中反应的离子方程式为Zn+Fe3+=Fe2++Zn2+、Zn+Cu2+=Cu+Zn2+.
(3)氢氧化物开始沉淀的pH如表:
| 氢氧化物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 |
| 开始沉淀pH | 1.5 | 3.3 | 7.6 |
(4)如图2是Na2SO4和Na2SO4•10H2O的溶解度(g/100g水)曲线,又知MnSO4和ZnSO4的溶解度随温度的升高而增大,则流程Ⅳ得到Na2SO4固体的操作是:将分离出MnCO3和ZnCO3后的滤液升温结晶、趁热过滤、乙醇洗涤、干燥,要“趁热”过滤的原因是防止形成Na2SO4•10H2O.
(5)流程Ⅴ的条件是电解,电解时均用惰性电极,阳极发生的电极反应可表示为Mn2+-2e-+2H2O=MnO2+4H+.
(6)取1.95g锌加入到12.00mL 18.4mol/L的浓硫酸中(反应中只生成一种还原产物),充分反应后,小心地将溶液稀释到1000mL,取出15.00mL,以酚酞为指示剂,用0.25mol/L的NaOH溶液滴定余酸,耗用NaOH溶液的体积为21.70mL.
①反应后溶液中多余的硫酸是0.18 mol.
②通过计算确定浓硫酸被还原的产物是S.
分析 依据流程图分析可知,流程Ⅰ中软锰矿和闪锌矿在硫酸溶液发生反应生成二氧化硫气体,过滤得沉淀硫,及滤液中含有MnSO4、ZnSO4、CuSO4、Fe2(SO4)3、Al2(SO4)3等,流程Ⅱ中加入锌,将铁离子还原成亚铁离子,铜离子被还原成铜单质,流程Ⅲ中,加入MnO2将亚铁离子氧化成铁离子同时消耗酸而得到氢氧化铁和氢氧化铝沉淀,滤液中含有硫酸锰和硫酸锌,流程Ⅳ为滤液中加入碳酸钠得碳酸锰、碳酸锌可循环利用,滤液为硫酸钠溶液,流程Ⅴ为电解硫酸锰和硫酸锌混合溶液可得二氧化锰和锌,据此答题;
(6)①根据硫酸和氢氧化钠之间的中和反应来确定剩余的硫酸的物质的量;
②根据电子守恒和化合价变化之间的关系来计算.
解答 解:(1)流程Ⅰ中软锰矿和闪锌矿在硫酸溶液发生反应生成二氧化硫气体,过滤得沉淀硫,及滤液中含有MnSO4、ZnSO4、CuSO4、Fe2(SO4)3、Al2(SO4)3等,其中FeS、CuS中硫元素及铁元素化合价都升高,所以被氧化的物质为,
故答案为:FeS、CuS;
(2)流程Ⅱ中加入锌,将铁离子还原成亚铁离子,铜离子被还原成铜单质,反应的离子方程式为Zn+Fe3+=Fe2++Zn2+、Zn+Cu2+=Cu+Zn2+,
故答案为:Zn+Fe3+=Fe2++Zn2+、Zn+Cu2+=Cu+Zn2+;
(3)图表数据可知,亚铁离子沉淀完全的pH为7.6,而铁离子沉淀完全的pH为1.5,所以要将亚铁离子氧化成铁离子,使铁元素能全部沉淀,
故答案为:使铁元素能全部沉淀;
(4)图象分析可知温度高时析出硫酸钠,温度低时析出硫酸钠结晶水合物晶体,所以需要趁热过滤;洗涤晶体时用乙醇洗涤避免形成结晶水合物,
故答案为:乙醇洗涤;防止形成 Na2SO4•10H2O;
(5)流程图中得到产物为二氧化锰和锌分析,得到锌是锌离子在阴极得到电子析出;二氧化锰是在阳极锰离子失电子生成,电极反应为:Mn2+-2e-+2H2O=MnO2+4H+;
故答案为:Mn2+-2e-+2H2O=MnO2+4H+;
(6)①硫酸和氢氧化钠之间中和的实质是:H++OH-=H2O,用0.25mol/L的NaOH溶液中和余酸,耗用NaOH溶液的体积为21.70mL,这些氢氧化钠中和掉的硫酸的物质的量0.25mol/L×0.0217L×$\frac{1}{2}$=0.0027mol,剩余硫酸的物质的量0.0027mol×$\frac{1000}{15}$≈0.18mol,
故答案为:0.18;
②取1.95g锌加入到12.00mL18.4mol/L的浓硫酸中(反应中只生成一种还原产物),消耗的硫酸的物质的量是0.012L×18.4mol/L-0.18mol=0.0408mol.设硫酸的还原产物中,硫元素的化合价是n,金属锌的物质的量是:$\frac{1.95g}{65g/mol}$=0.03mol,生成硫酸锌的物质的量是0.03mol,所以0.03mol的硫酸显示酸性,根据电子守恒:$\frac{1.95g}{65g/mol}$×(2-0)=(0.0408mol-0.03mol)×(6-n),解得n=0,所以浓硫酸被还原的产物是硫单质,
故答案为:S.
点评 本题考查了物质制备实验的分析判断、物质溶解性的理解应用、电解原理的应用、实验基本操作、化学计算等,题目难度较大,答题时注意元素守恒、极限反应的灵活应用.

 教材全解字词句篇系列答案
教材全解字词句篇系列答案| A. | SO2可用于杀菌、消毒,但不可用来加工食品 | |
| B. | 液氨汽化时要吸收大量热,因此氨常用作制冷剂 | |
| C. | PM2.5是指大气中直径小于或等于2.5微米的细小可吸入颗粒物,其分散在空气中能形成气溶胶 | |
| D. | 铝箔在酒精灯上加热铝熔化但不滴落,说明氧化铝的熔点高于铝的熔点 |
| J | ||||
| R |
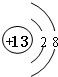 ;元素T周期表中位于第ⅦA族.
;元素T周期表中位于第ⅦA族.(2)J和氢组成的化合物分子有4个原子,其结构式为H-C≡C-H.
(3)M和T形成的化合物在潮湿的空气中冒白色烟雾,反应的化学方程式为AlCl3+3H2O=Al(OH)3+3HCl↑.
(4)L的最简单气态氢化物甲的水溶液显碱性.
①在微电子工业中,甲的水溶液可作刻蚀剂H2O2 的清除剂,所发生反应的产物不污染环境,其化学方程式为2NH3•H2O+3H2O2=N2+8H2O.
②由甲与氧气、KOH 溶液构成原电池,负极会产生L的单质.则其负极反应式为2NH3-6e-+6OH-═N2+6H2O.
(5)由J、R形成的液态化合物JR2 0.2mol在O2中完全燃烧,生成两种气态氧化物,298K时放出热量215kJ. 该反应的热化学方程式为CS2(l)+3O2(g)=CO2(g)+2SO2(g)△H=-1075KJ/mol.
| A. | 氢能源的优点是来源广泛、无污染、便于运输与贮存 | |
| B. | 自然界中利用太阳能最成功的是植物的光合作用 | |
| C. | 植物秸秆、动物粪便、枯枝败叶中蕴藏着丰富的生物质能 | |
| D. | 利用太阳能、风能和氢能替代化石能源能改善空气质量 |
 某学习小组探究溴乙烷的消去反应并验证产物.
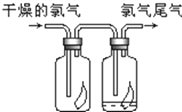
某学习小组探究溴乙烷的消去反应并验证产物. 某实验小组对中学课本中可生成氢气的反应进行了研究,总结出三个可以生成H2的反应:①Zn+盐酸 ②Na+水 ③Al+NaOH溶液.为分析上述三个反应生成的H2,他们设计了如下装置图.
某实验小组对中学课本中可生成氢气的反应进行了研究,总结出三个可以生成H2的反应:①Zn+盐酸 ②Na+水 ③Al+NaOH溶液.为分析上述三个反应生成的H2,他们设计了如下装置图.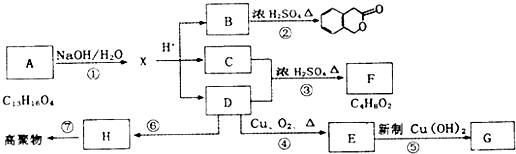
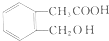
 ④
④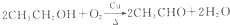 .
. (1)瑞典化学家舍勒将软锰矿(主要成分MnO2)与浓盐酸混合加热,在世界上首先制得了氯气.写出该反应的离子方程式,并用双线桥画出电子转移的方向和数目.
(1)瑞典化学家舍勒将软锰矿(主要成分MnO2)与浓盐酸混合加热,在世界上首先制得了氯气.写出该反应的离子方程式,并用双线桥画出电子转移的方向和数目.