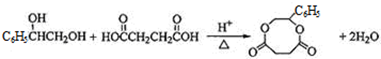题目内容
11.下列由实验或已有知识得出的结论错误的是( )| A. | SO2可用于杀菌、消毒,但不可用来加工食品 | |
| B. | 液氨汽化时要吸收大量热,因此氨常用作制冷剂 | |
| C. | PM2.5是指大气中直径小于或等于2.5微米的细小可吸入颗粒物,其分散在空气中能形成气溶胶 | |
| D. | 铝箔在酒精灯上加热铝熔化但不滴落,说明氧化铝的熔点高于铝的熔点 |
分析 A.二氧化硫有毒;
B.依据液氨汽化吸收热量解答;
C.胶体粒子的直径介于1nm~100nm之间;
D.氧化铝的熔点高于铝的熔点.
解答 解:A.SO2有毒,能够使蛋白质变性,可用于杀菌、消毒,但不可用来加工食品,故A正确;
B.液氨汽化吸收热量,具有制冷作用,常用作制冷剂,故B正确;
C.胶体粒子的直径介于1nm~100nm(10-9m~10-7m)之间,PM2.5是指大气中直径≤2.5×10-6m的颗粒物,不一定为胶体,故C错误;
D.氧化铝的熔点高于铝的熔点,加热铝时在表面生成熔点较高的氧化铝而不滴落,故D正确;
故选:C.
点评 本题考查了元素化合物、胶体的性质,熟悉二氧化硫、氨气、氧化铝、胶体的性质是解题关键,侧重考查学生对基础知识的掌握.

练习册系列答案
 学习实践园地系列答案
学习实践园地系列答案
相关题目
2.从下列事实,找出不能用勒沙特列原理解释的是( )
| A. | 在溴水中存在如下平衡:Br2+H2O=HBr+HBrO,当加入NaOH溶液后颜色变浅 | |
| B. | 对2HI?H2+I2(气)平衡体系增加压强使颜色变深 | |
| C. | 反应CO+NO2?CO2+NO+Q升高温度使平衡向逆方向移动 | |
| D. | 合成氨反应:N2+3H2?2NH3+Q,为使氨的产率提高,理论上应采取低温高压的措施 |
6.取体积相同的KI、Na2SO3、FeBr2溶液,分别通入足量氯气,当恰好完全反应时,三种溶液消耗氯气的物质的量相同,则KI、Na2SO3、FeBr2溶液的物质的量浓度之比为( )
| A. | 2:1:2 | B. | 2:1:3 | C. | 6:3:2 | D. | 3:7:1 |
16.某地有软锰矿和闪锌矿两座矿山,它们的组成(质量分数)如表:
科研人员开发了综合利用这两种资源的同槽酸浸工艺,工艺流程如图1所示.
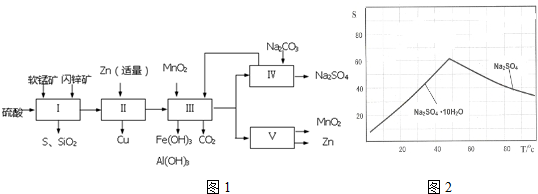
(1)流程Ⅰ所得滤液中含有MnSO4、ZnSO4、CuSO4、Fe2(SO4)3、Al2(SO4)3等,则流程Ⅰ中被氧化的物质有FeS、CuS种.
(2)流程Ⅱ中反应的离子方程式为Zn+Fe3+=Fe2++Zn2+、Zn+Cu2+=Cu+Zn2+.
(3)氢氧化物开始沉淀的pH如表:
流程Ⅲ中MnO2的作用是将Fe2+氧化成Fe3+,不直接生成Fe(OH)2沉淀的原因是使铁元素能全部沉淀.
(4)如图2是Na2SO4和Na2SO4•10H2O的溶解度(g/100g水)曲线,又知MnSO4和ZnSO4的溶解度随温度的升高而增大,则流程Ⅳ得到Na2SO4固体的操作是:将分离出MnCO3和ZnCO3后的滤液升温结晶、趁热过滤、乙醇洗涤、干燥,要“趁热”过滤的原因是防止形成Na2SO4•10H2O.
(5)流程Ⅴ的条件是电解,电解时均用惰性电极,阳极发生的电极反应可表示为Mn2+-2e-+2H2O=MnO2+4H+.
(6)取1.95g锌加入到12.00mL 18.4mol/L的浓硫酸中(反应中只生成一种还原产物),充分反应后,小心地将溶液稀释到1000mL,取出15.00mL,以酚酞为指示剂,用0.25mol/L的NaOH溶液滴定余酸,耗用NaOH溶液的体积为21.70mL.
①反应后溶液中多余的硫酸是0.18 mol.
②通过计算确定浓硫酸被还原的产物是S.
| 软锰矿 | 闪锌矿 |
| MnO2约70%,SiO2约20%,Al2O3约4%,其余为水分 | ZnS约80%,FeS、CuS、SiO2共约7%,其余为水分 |

(1)流程Ⅰ所得滤液中含有MnSO4、ZnSO4、CuSO4、Fe2(SO4)3、Al2(SO4)3等,则流程Ⅰ中被氧化的物质有FeS、CuS种.
(2)流程Ⅱ中反应的离子方程式为Zn+Fe3+=Fe2++Zn2+、Zn+Cu2+=Cu+Zn2+.
(3)氢氧化物开始沉淀的pH如表:
| 氢氧化物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 |
| 开始沉淀pH | 1.5 | 3.3 | 7.6 |
(4)如图2是Na2SO4和Na2SO4•10H2O的溶解度(g/100g水)曲线,又知MnSO4和ZnSO4的溶解度随温度的升高而增大,则流程Ⅳ得到Na2SO4固体的操作是:将分离出MnCO3和ZnCO3后的滤液升温结晶、趁热过滤、乙醇洗涤、干燥,要“趁热”过滤的原因是防止形成Na2SO4•10H2O.
(5)流程Ⅴ的条件是电解,电解时均用惰性电极,阳极发生的电极反应可表示为Mn2+-2e-+2H2O=MnO2+4H+.
(6)取1.95g锌加入到12.00mL 18.4mol/L的浓硫酸中(反应中只生成一种还原产物),充分反应后,小心地将溶液稀释到1000mL,取出15.00mL,以酚酞为指示剂,用0.25mol/L的NaOH溶液滴定余酸,耗用NaOH溶液的体积为21.70mL.
①反应后溶液中多余的硫酸是0.18 mol.
②通过计算确定浓硫酸被还原的产物是S.
3.化学与生活密切相关.下列说法不正确的是( )
| A. | 乙烯可用作水果的催熟剂 | |
| B. | 二氧化硫可用作食品的漂白剂 | |
| C. | 交警可用酸性重铬酸钾来检测司机是否酒驾 | |
| D. | 黄铜(铜锌合金)制作的铜锣不易产生铜绿 |
20.向含有下列各组离子的溶液中滴加NaOH溶液,得到白色沉淀的是( )
| A. | Ba2+ HCO3- K+ Cl- | B. | CO32- OH- Na+ NO3- | ||
| C. | OH- Na+ SO42- CO32- | D. | Cu2+ Cl- Na+ NO3- |
 .
.
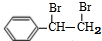
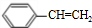 +Br2→
+Br2→