题目内容
16.明矾石是制取钾肥和氢氧化铝的重要原料,明矾石的组成和明矾相似,此外还含有氧化铝和少量的氧化铁杂质.具体实验流程如图: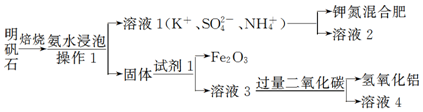
请回答下列问题:
(1)操作1所用到的玻璃仪器的名称是漏斗、烧杯、玻璃棒.
(2)由溶液3制取氢氧化铝的离子方程式为AlO2-+CO2+H2O=Al(OH)3+HCO3-.
(3)请你写出验证溶液1中有NH4+的实验过程:取少量溶液1于试管中,加入浓氢氧化钠溶液加热,有能使湿润的红色石蕊试纸变蓝的气体生成,证明溶液1中含有NH4+.
(4)实验室用Fe2O3与CO反应来制取单质Fe.
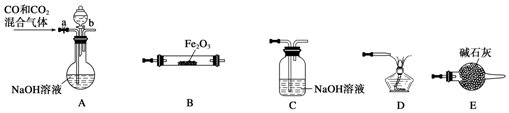
①请按气流由左到右的方向连接下列各装置,顺序为A→E→B→C→D.
②检查装置A气密性的方法是关闭a、b两处活塞,将导气管插入水槽中,微热,导气管口有气泡产生,停止微热,一段时间后,导管中形成一段水柱,说明气密性良好.
③在点燃B处的酒精灯前,应进行的操作是检验CO气体纯度;
④装置C的作用是除去CO气体混有的二氧化碳,利用CO点燃.
分析 (1)将液体和不溶于液体的固体分离开来的操作是过滤;
(2)明矾石的组成和明矾相似,还含有氧化铝和少量的氧化铁杂质,可知固体为氢氧化铝、氧化铝、氧化铁.试剂1将铝元素转化到溶液3中,并将氧化铁除掉,所以试剂1为强碱,溶液3中含有偏铝酸根,通入二氧化碳,生成氢氧化铝沉淀;
(3)铵根离子与强碱反应,转化为氨气,氨气能使湿润的红色石蕊试纸变蓝;
(4)①根据各部分装置的作用连接;
②利用气体的热胀冷缩;
③CO为易燃气体,加热要检验其纯度;
④CO有毒,直接排放空气中,污染大气,通过燃烧方法转化为二氧化碳,从B中出来的气体含有二氧化碳,不利于CO点燃.
解答 解:(1)将液体和不溶于液体的固体分离开来的操作是过滤,过滤用到的玻璃仪器为漏斗、烧杯、玻璃棒,
故答案为:漏斗、烧杯、玻璃棒;
(2)溶液3中含有偏铝酸根,通入过量二氧化碳,反应生成氢氧化铝沉淀与碳酸氢根离子,反应离子方程式为AlO2-+CO2+H2O=Al(OH)3+HCO3-,
故答案为:AlO2-+CO2+H2O=Al(OH)3+HCO3-;
(3)验证溶液l中有NH4+的实验操作为:取少量溶液1于试管中,加入浓氢氧化钠溶液加热,有能使湿润的红色石蕊试纸变蓝的气体生成,证明溶液1中含有NH4+,
故答案为:取少量溶液1于试管中,加入浓氢氧化钠溶液加热,有能使湿润的红色石蕊试纸变蓝的气体生成,证明溶液1中含有NH4+;
(4)①A作用除去CO中混有的二氧化碳,B为Fe2O3与CO反应装置,C作用为吸收从B中出来的气体混有的二氧化碳,D作用为燃烧剩余的CO,E作用为干燥进入B装置的气体.所以各装置顺序为:A→E→B→C→D,
故答案为:E→B→C→D;
②利用气体的热胀冷缩检验气密性.操作为:关闭a、b两处活塞,将导气管插入水槽中,微热,导气管口有气泡产生,停止微热,一段时间后,导管中形成一段水柱,说明气密性良好,
故答案为:关闭a、b两处活塞,将导气管插入水槽中,微热,导气管口有气泡产生,停止微热,一段时间后,导管中形成一段水柱,说明气密性良好;
③CO为易燃气体,不纯受热会发生爆炸危险,所以在加热前要检验其纯度,
故答案为:检验CO气体纯度;
④从B中出来的气体含有二氧化碳,不利于CO点燃,C装置作用为除去CO气体混有的二氧化碳,利用CO点燃,
故答案为:除去CO气体混有的二氧化碳,利用CO点燃.
点评 本题考查了物质分离与提纯方法的综合应用,为高考常见题型,明确实验目的、实验原理为解答关键,注意熟练掌握化学实验基本操作方法,明确物质分离与提纯方法及其应用,试题知识点较多、综合性较强,充分考查了学生的分析能力及灵活应用能力,题目难度中等.

| A. | 次氯酸分子的电子式 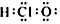 | B. | CH4Si的结构式 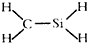 | ||
| C. | HCN分子的结构式:H-C≡N | D. | 丙烷分子的比例模型  |
 请按要求回答下列有关氮的化合物参与相关反应的问题:
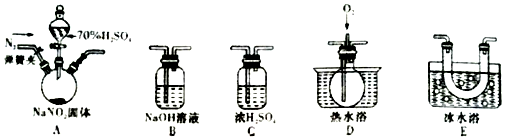
请按要求回答下列有关氮的化合物参与相关反应的问题:Ⅰ、工业上常用NH4Cl溶液将有毒的NaNO2废液进行无害处理,写出该反应的离子方程式:NH4++NO2-=N2↑+2H2O.
Ⅱ、已知汽车尾气净化原理之一:2NO(g)+2CO(g)?N2(g)+2CO2(g)△H<0;
(1)判断该反应能自发进行的条件是低温.
(2)一定温度下,若在体积为2L的密闭容器中发生该化学反应,0~4min各物质的物质的量的变化(部分数据)如表所示:
| n(NO)/mol | n(CO)/mol | n(N2)/mol | n(CO2)/mol | |
| 起始 | 1.2 | 1.0 | 0 | 0 |
| 2min末 | 0.4 | |||
| 4min末 | 0.8 |
②此温度下该反应的化学平衡常数的值K=80;
平衡时CO的转化率α(CO)=80%.
(3)在恒温恒压条件下,下列叙述可确定该反应已达平衡的是CD.
A.消耗v(CO)等于消耗v(NO) B.N2与CO2的物质的量之比为1:1时
C.混合气体的密度保持不变 D.气体平均相对分子质量保持不变
(4)若一定温度下,将一定量的NO、CO充入容积可变的密闭容器中,该反应达到平衡状态时容积为3L,c(N2)随时间t的变化曲线如图所示.
①在t2min时改变的条件是快速将容器的体积由3L压到2L.
②若将容器保持3L恒定,在t2min时升高温度,t3min时该反应重新达到平衡,请在上图中画出在t2~t4内c(N2)的变化曲线.
①烧杯 ②坩埚 ③蒸发皿 ④试管 ⑤蒸馏烧瓶 ⑥锥形瓶 ⑦燃烧匙.
| A. | ③⑥⑦ | B. | ①⑤⑥ | C. | ②③⑤ | D. | ④⑤⑥⑦ |
| A. | 酸性氧化物:CO2、SO2、H2O | B. | 碱性氧化物:Na2O、CaO、P2O5 | ||
| C. | 碱:NaOH、KOH、Ba(OH)2 | D. | 铵盐:NH4Cl、NH4NO3、(NH4)2SO4 |
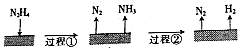
已知:200℃时:
Ⅰ.3N2H4(g)═N2(g)+4NH3(g)△H1=-32.9kJ•mol-1;
Ⅱ.N2H4(g)+H2(g)═2NH3(g)△H2=-41.8kJ•mol-1.
下列说法不正确的是( )
| A. | 肼属于共价化合物 | |
| B. | 图示过程①、②都是吸热反应 | |
| C. | 反应Ⅰ中氧化剂与还原剂的物质的量之比为2:1 | |
| D. | 200℃时,肼分解的热化学方程式为:N2H4(g)═N2(g)+2H2(g)△H═+50.7kJ•mol-1 |
部分短周期元素的原子半径及主要化合价
| 元素 | A | B | C | D | E | F | G | H |
| 原子半 径(nm) | 0.130 | 0.118 | 0.090 | 0.102 | 0.073 | 0.154 | 0.037 | 0.099 |
| 主要 化合价 | +2 | +3 | +2 | +6,-2 | -2 | +1 | +1 | +7,-1 |
(2)B、H两元素的最高价氧化物所对应的水化物相互反应的离子方程式是Al(OH)3+3H+═Al3++3H2O.
(3)实验室中制取H单质反应的化学方程式是MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O.
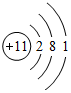 ,B离子的电子式
,B离子的电子式 ,C原子的名称氢原子,D原子的电子式
,C原子的名称氢原子,D原子的电子式 .
.