题目内容
6.亚硝酸钠(NaNO2)有像食盐一样的咸味,被称为工业盐.已知:亚硝酸是弱酸,且NO+NO2+2NaOH═2NaNO2+H2O.某同学据此认为NaNO2可与硫酸反应,且有NO和NO2生成,并欲用如图所示仪器(夹持装置已省略)及药品,验证自己的假设.已知沸点:NO2为21℃,NO为-151℃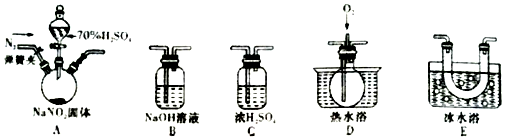
(1)上述仪器的连接顺序为:A→C→E→D→B.
(2)反应前,先打开弹簧夹,通入一段时间氮气,其目的是排除装置中的空气,防止将可能生成的NO氧化成NO2,干扰NO和NO2的检验.
(3)关闭弹簧夹,打开分液漏斗活塞,滴入70%硫酸后,A中产生了红棕色气体,
①依据D中通入O2出现红棕色气体现象,可确认产物中有NO
②装置E的作用是冷凝,使NO2完全液化.
(4)如果没有装置C,对实验结论的影响是水蒸气会与NO2反应产生NO,导致无法确认NO的来源.
(5)综合以上信息推断,NO2与NaOH溶液发生反应的化学方程式为2NO2+2NaOH=NaNO3+NaNO2+H2O.
(6)己知:2NaNO2+4HI═2NaI+I2+2NO+2H2O,根据这一反应,可以用试剂和生活中的常见物质鉴别亚硝酸钠和食盐,进行实验时,必须选用的物质有BCE.
A.自来水 B.碘化钾溶液 C.淀粉 D.白糖 E.食醋 F.白酒.
分析 实验时应先通入氮气,可将装置内的空气排出,生成气体由A进入C中进行干燥,先经过E冷却分离出NO2,在D中氧气和NO反应生成NO2,可观察到气体由无色变为红棕色,最后连接B,为气体的尾气处理装置,防止污染空气,以此解答该题.
解答 解:(1)由以上分析可知连接顺序为A→C→E→D→B,故答案为:C;E;D;
(2)实验时应先通入氮气,可将装置内的空气排出,目的是防止将可能生成的NO氧化成NO2,干扰NO和NO2的检验,
故答案为:排除装置中的空气,防止将可能生成的NO氧化成NO2,干扰NO和NO2的检验;
(3)①D中通入O2出现红棕色气体,可说明有NO生成,被氧气氧化生成二氧化氮,故答案为:D中通入O2出现红棕色气体;
②NO2沸点为21℃,易液化,则装置E的作用是冷凝,使NO2完全液化,以达到分离的目的,
故答案为:冷凝,使NO2完全液化;
(4)浓硫酸起到干燥作用,如没有浓硫酸的干燥,则水蒸气会与NO2反应产生NO,导致无法确认NO的来源,故答案为:水蒸气会与NO2反应产生NO,导致无法确认NO的来源;
(5)NO2与NaOH溶液发生反应生成硝酸钠、亚硝酸钠,反应的化学方程式为2 NO2+2NaOH=NaNO3+NaNO2+H2O,
故答案为:2 NO2+2NaOH=NaNO3+NaNO2+H2O;
(6)鉴别亚硝酸钠和食盐,可根据反应2NaNO2+4HI═2NaI+I2+2NO+2H2O判断,可加入醋酸、KI、淀粉等,故答案为:BCE.
点评 本题综合考查物质的制备、性质实验,为高考常见题型和高频考点,侧重考查学生的分析、实验能力,注意把握实验的原理以及物质的性质,难度中等.

练习册系列答案
相关题目
17.将等物质的量的X、Y气体充入一个容积可变的密闭容器中,在一定条件下发生如下反应并达到平衡:X(g)+Y(g)?3Z(g)△H<0.当改变某个条件并维持新条件直至达到新平衡,表中关于新平衡与原平衡的比较,正确的是( )
| 选择 | 改变的条件 | 正、逆反应速率变化 | 新平衡和原平衡比较 |
| A | 增大压强 | 正、逆反应速率都增大量 | Z的浓度减小 |
| B | 充入少量Z | 逆反应速率增大 | X的体积分数不变 |
| C | 充入少量Z | v(逆)>v(正) | Z的浓度减小 |
| D | 升高温度 | 逆反应速率增大量大于 正反应速率增大量 | Z的体积分数变大 |
| A. | A | B. | B | C. | C | D. | D |
14.下列有关实验操作、现象及结论解释都没有科学性错误的是( )
| 选项 | 操作 | 现象 | 结论解释 |
| A | 过量铁粉与稀HNO3充分反应后滴入KSCN溶液 | 溶液变红 | 稀HNO3将铁氧化成Fe3+ |
| B | 某实验小组从资料上获得信息:Fe3+可以氧化银单质,他们用这种方法清洗一批做了银镜反应实验的试管,配制Fe3+的浓度相同的FeCl3溶液和Fe2(SO4)3溶液,分别用于清洗试管 | 用FeCl3溶液清洗比用Fe2(SO4)3溶液清洗干净 | Fe3+氧化银单质的过程可能是一个可逆过程:Fe3++Ag?Fe2++Ag+ |
| C | 在苯酚钠溶液中通入少量CO2气体 | 溶液变浑浊 | 碳酸的酸性比苯酚的强,溶液中还有Na2CO3生成 |
| D | 向硅酸钠溶液中滴入酚酞溶液,再滴加稀盐酸 | 溶液变红,后溶液红色变浅直至消失 | 非金属性:Cl>Si |
| A. | A | B. | B | C. | C | D. | D |
1.将铜和镁组成的2.24g混合物投入适量某浓度的硝酸中完全反应,还原产物中有NO2、NO、N2O三种气体,且体积均为0.224L(标准状况),然后向反应后的溶液中,加入足量的NaOH溶液,所得沉淀经过滤、洗涤、干燥后称量,质量为( )
| A. | 3.12g | B. | 4.28g | C. | 4.68g | D. | 5.08g |
18.膦(PH3)在常温下是一种无色有大蒜臭味的有毒气体,电石气的杂质中常含之.它的分子是三角锥形.以下关于PH3的叙述中,正确的是( )
| A. | PH3是非极性分子 | |
| B. | PH3分子中有未成键的电子对 | |
| C. | PH3中的P-H键的极性比NH3中N-H键的极性弱 | |
| D. | PH3分子中的P-H键是非极性键 |
15.在一定条件下的定容密闭容器中,发生反应2SO2(g)+O2(g)?2SO3(g),下列哪种情况,能表明反应达到平衡状态( )
| A. | SO3的体积百分含量保持不变 | |
| B. | SO2速率是O2速率的2倍 | |
| C. | SO3的浓度是O2浓度的2倍 | |
| D. | 单位时间内SO2消耗的浓度等于SO3生成的浓度 |
16.H2O、BF3 的杂化类型分别是( )
| A. | sp3、sp2 | B. | sp3、sp | C. | sp2、sp | D. | sp2、sp3 |
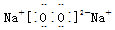 ;AB2的结构式是O=C=O.
;AB2的结构式是O=C=O.