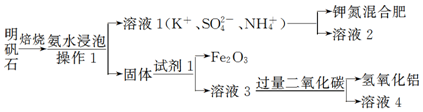
题目内容
18. 请按要求回答下列有关氮的化合物参与相关反应的问题:
请按要求回答下列有关氮的化合物参与相关反应的问题:Ⅰ、工业上常用NH4Cl溶液将有毒的NaNO2废液进行无害处理,写出该反应的离子方程式:NH4++NO2-=N2↑+2H2O.
Ⅱ、已知汽车尾气净化原理之一:2NO(g)+2CO(g)?N2(g)+2CO2(g)△H<0;
(1)判断该反应能自发进行的条件是低温.
(2)一定温度下,若在体积为2L的密闭容器中发生该化学反应,0~4min各物质的物质的量的变化(部分数据)如表所示:
| n(NO)/mol | n(CO)/mol | n(N2)/mol | n(CO2)/mol | |
| 起始 | 1.2 | 1.0 | 0 | 0 |
| 2min末 | 0.4 | |||
| 4min末 | 0.8 |
②此温度下该反应的化学平衡常数的值K=80;
平衡时CO的转化率α(CO)=80%.
(3)在恒温恒压条件下,下列叙述可确定该反应已达平衡的是CD.
A.消耗v(CO)等于消耗v(NO) B.N2与CO2的物质的量之比为1:1时
C.混合气体的密度保持不变 D.气体平均相对分子质量保持不变
(4)若一定温度下,将一定量的NO、CO充入容积可变的密闭容器中,该反应达到平衡状态时容积为3L,c(N2)随时间t的变化曲线如图所示.
①在t2min时改变的条件是快速将容器的体积由3L压到2L.
②若将容器保持3L恒定,在t2min时升高温度,t3min时该反应重新达到平衡,请在上图中画出在t2~t4内c(N2)的变化曲线.
分析 Ⅰ.NH4Cl和NaNO2反应生成N2,NaCl和H2O,并据强酸,强碱,大多数盐拆,书写离子方程式;
Ⅱ.(1)据△G=△H-T△S,进行判断,若△G<0,反应能自发进行,据此进行分析;
(2)①据v=$\frac{△c}{△t}$进行计算;
②据K=$\frac{C({N}_{2}){C}^{2}(C{O}_{2})}{{C}^{2}(NO){C}^{2}(CO)}$进行计算;据方程式前面的系数,4minCO20.8mol,故CO的变化量为0.8mol,据v(CO)=$\frac{n变}{n原}×100%$,进行分析;
(3)根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态;
(4)①据影响平衡移动的因素分析;
②据温度升高反应向吸热方向进行作图;
解答 解:Ⅰ.NH4Cl+NaNO2=N2+NaCl+2H2O,并据强酸,强碱,大多数盐拆,故离子方程式为NH4++NO2-=N2↑+2H2O,
故答案为:NH4++NO2-=N2↑+2H2O;
Ⅱ.(1)据△G=△H-T△S,若△G<0,反应能自发进行,此反应△S<0,△H<0,故只有低温时才能确保△G<0,
故答案为:低温;
(2)①2NO(g)+2CO(g)?N2(g)+2CO2(g)△H<0
开始(c) 0.6 0.5 0 0
变化 0.4 0.4 0.2 0.4
2min 0.2 0.1 0.2 0.4
v(NO)=$\frac{0.4mol/L}{2min}$=0.2mol/(L.min),
故答案为:0.2mol/(L.min);
②K=$\frac{C({N}_{2}){C}^{2}(C{O}_{2})}{{C}^{2}(NO){C}^{2}(CO)}$=$\frac{0.2×0.{4}^{2}}{0.{2}^{2}×0.{1}^{2}}$=80;
据方程式前面的系数,4minCO20.8mol,故CO的变化量为0.8mol,据v(CO)=$\frac{0.8mol}{1.0mol}×100%$=80%,
故答案为:80;80%;
(3)A.消耗CO和消耗NO都指的是正反应,故不能说明反应达到平衡,故A错误;
B.N2与CO2的物质的量之比为1:1时,不能说明体系浓度不变,故不能说明反应达到平衡,故B错误;
C.这是一个气体体积变化的反应,混合气体的密度保持不变,即浓度不变,故能说明反应达到平衡,故C正确;
D..这是一个气体体积变化的反应,气体平均相对分子质量保持不变,即气体总物质的量不变,体积是定值,由c=$\frac{n}{V}$,即浓度不变,故能说明反应达到平衡,故D正确;
故答案为:CD;
(4)①t2min时氮气的浓度瞬间从3mol/L变化到4.5mol/L,故t2min时改变的条件是快速将容器的体积由3L压到2L,
故答案为:快速将容器的体积由3L压到2L;
②由于温度升高反应向吸热方向进行,故t2~t4内c(N2)的变化曲线为 ;
;
答:t2~t4内c(N2)的变化曲线为 .
.
点评 本题考查化学反应速率计算、化学平衡计算、化学平衡状态判断,难度不大,侧重对基础知识的巩固,注意判断化学平衡状态的物理量应随反应进行发生变化,该物理量由变化到不再变化说明到达平衡.

 名校课堂系列答案
名校课堂系列答案| A. | 从溶解的整个过程来看,既包含着物理变化,又包含着化学变化 | |
| B. | 氯化钠溶于水达到饱和后,溶解过程并没有停止 | |
| C. | 氯化钠溶于水中,无论是否形成饱和溶液,都存在溶解与结晶的过程 | |
| D. | 将K37Cl投入到K35Cl的饱和溶液中,溶液中溶质的质量会减小 |
| A. | 电解饱和氯化镁溶液:2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$H2↑+Cl2↑+2OH- | |
| B. | Fe(OH)3溶于氢碘酸:Fe(OH)3+3H+═Fe3++3H2O | |
| C. | NaAlO2溶液中AlO2-的水解:AlO2-+2H2O═Al(OH)3+OH- | |
| D. | 向KAl(SO4)2溶液中加过量的Ba(OH)2溶液:Al3++2SO42-+2Ba2++4OH-═AlO2-+2BaSO4↓+2H2O |
| 温度/℃ | 700 | 800 | 830 | 1000 | 1200 |
| 平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
(1)该反应的平衡常数表达式K=$\frac{c(C)c(D)}{c(A)c(B)}$,该反应为放热反应(选填“吸热”、“放热”).当反应达到平衡时,升高温度,A的转化率减小(选填“增大”、“减小”或“不变”).
(2)830℃时,向一个5L的密闭容器中充入0.20mol的A和0.80mol的B,如反应初始6s内A的平均反应速率v(A)=0.003mol/(L•s),则6s时c(A)=0.022mol/L,C的物质的量为0.09mol.
(3)一定条件下,向体积为2L的恒容密闭容器中充入1molA(g)和3molB(g),判断该反应达到平衡状态的依据是d.
a.c(A)=c(C) b.容器中压强不变
c.混合气体的平均相对分子质量不变 d.v逆(D)=v正(B)
(4)1200℃时反应C(g)+D(g)?A(g)+B(g)的平衡常数的值为2.5.
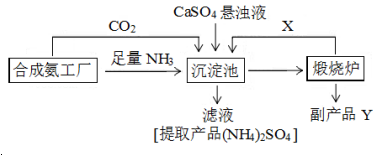
请回答以下问题:
(1)下列有关(NH4)2SO4溶液的说法正确的是
A.电离方程式:(NH4)2SO4?2NH4++SO42-
B.水解离子方程式:NH4++H2O?NH3•H2O+H+
C.离子浓度关系:c(NH4+)+c(H+)═c(SO42-)+c(OH-)
D.微粒浓度大小:c(NH4+)>c(SO42-)>c(H+)>c(NH3•H2O)>c(OH-)
(2)硫酸工业中,V2O5作催化剂时发生反应2SO2+O2?2SO3,SO2的转化率与温度、压强有关,请根据下表信息,结合工业生产实际,选择表中最合适的温度和压强分别是420℃、1.01×105Pa.该反应420℃时的平衡常数>520℃时的平衡常数(填“>”、“<”或“=”).
 | 1.01×105Pa | 5.05×105Pa | 1.01×106Pa |
| 420℃ | 0.9961 | 0.9972 | 0.9984 |
| 520℃ | 0.9675 | 0.9767 | 0.9852 |
| 620℃ | 0.8520 | 0.8897 | 0.9276 |
(4)副产品Y是氧化钙.沉淀池中发生的主要反应方程式是CaSO4+CO2+2NH3+H2O→CaCO3↓+(NH4)2SO4.
(5)从绿色化学和资源综合利用的角度说明上述流程的主要优点是产生的CO2循环使用,物质充分利用,副产品有用,无污染性物质产生.
| A. | 当a=b时,发生的离子总反应为:Ba2++2OH-+CO2═BaCO3↓+H2O | |
| B. | 当3a≤2b时发生的离子反应为:OH-+CO2═HCO3- | |
| C. | 当2a=b时,发生的离子总反应为:Ba2++3OH-+2CO2═BaCO3↓+H2O+HCO3- | |
| D. | 2a<b<3a时,溶液中n(HCO3-)=(2b-3a)mol |
| 选择 | 改变的条件 | 正、逆反应速率变化 | 新平衡和原平衡比较 |
| A | 增大压强 | 正、逆反应速率都增大量 | Z的浓度减小 |
| B | 充入少量Z | 逆反应速率增大 | X的体积分数不变 |
| C | 充入少量Z | v(逆)>v(正) | Z的浓度减小 |
| D | 升高温度 | 逆反应速率增大量大于 正反应速率增大量 | Z的体积分数变大 |
| A. | A | B. | B | C. | C | D. | D |