题目内容
17.下列化学用语正确的是( )| A. | 次氯酸分子的电子式 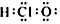 | B. | CH4Si的结构式 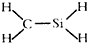 | ||
| C. | HCN分子的结构式:H-C≡N | D. | 丙烷分子的比例模型 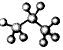 |
分析 A.次氯酸的中心原子是氧原子,次氯酸中不存在氢氯键,分子中存在1个氧氢键和一个氧氯键;
B.碳和硅属于同一主族,依据乙烯结构式 ,推断得到结构式;
,推断得到结构式;
C.HCN分子中C原子核外有4个电子,N原子核外有5个电子,分子内含有-C≡N;
D.图为球棍模型,黑色球代表C原子.
解答 解:A.H原子最外层1个电子,Cl原子最外层7个电子,O原子最外层6个电子,次氯酸中不存在氢氯键,分子中存在1个氧氢键和一个氧氯键,正确的电子式为 ,故A错误;
,故A错误;
B.碳和硅属于同一主族,依据乙烯结构推断得到结构式,CH4Si的结构式 ,故B错误;
,故B错误;
C.HCN分子中C原子核外有4个电子能形成4个共价键,N原子核外有5个电子能形成3个共价键,分子内含有-C≡N,结构式:H-C≡N,故C正确;
D. 为丙烷的球棍模型,丙烷的比例模型为:
为丙烷的球棍模型,丙烷的比例模型为: ,故D错误;
,故D错误;
故选C.
点评 本题考查化学用语,涉及电子式、结构式、球棍模型等,注意把握不同的化学用语并规范使用,题目难度不大.

练习册系列答案
相关题目
7.下列热化学方程式中,正确的是( )
| A. | 甲烷的燃烧热为890.3 kJ•mol-1,则甲烷燃烧的热化学方程式可表示为CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3 kJ•mol-1 | |
| B. | 500℃、30 MPa下,将0.5 mol N2(g)和1.5 mol H2(g)置于密闭容器中充分反应生成NH3(g)放热19.3 kJ,其热化学方程式为N2(g)+3H2(g)?2NH3(g)△H=-38.6 kJ•mol-1 | |
| C. | 在101 kPa时,2 g H2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式为2H2(g)+O2(g)═2H2O(l)△H=-571.6 kJ•mol-1 | |
| D. | HCl和NaOH反应的中和热△H=-57.3 kJ•mol-1,则H2SO4和Ca(OH)2反应的△H=2×(-57.3)kJ•mol-1 |
8.溶解并不仅仅是简单的将溶质分散到溶剂中,而是一个复杂的过程.下列有关溶解过程的说法错误的是( )
| A. | 从溶解的整个过程来看,既包含着物理变化,又包含着化学变化 | |
| B. | 氯化钠溶于水达到饱和后,溶解过程并没有停止 | |
| C. | 氯化钠溶于水中,无论是否形成饱和溶液,都存在溶解与结晶的过程 | |
| D. | 将K37Cl投入到K35Cl的饱和溶液中,溶液中溶质的质量会减小 |
9.下列指定反应的离子方程式书写正确的是( )
| A. | 电解饱和氯化镁溶液:2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$H2↑+Cl2↑+2OH- | |
| B. | Fe(OH)3溶于氢碘酸:Fe(OH)3+3H+═Fe3++3H2O | |
| C. | NaAlO2溶液中AlO2-的水解:AlO2-+2H2O═Al(OH)3+OH- | |
| D. | 向KAl(SO4)2溶液中加过量的Ba(OH)2溶液:Al3++2SO42-+2Ba2++4OH-═AlO2-+2BaSO4↓+2H2O |
6.已知A(g)+B(g)?C(g)+D(g) 反应的平衡常数和温度的关系如表:
完成下列填空:
(1)该反应的平衡常数表达式K=$\frac{c(C)c(D)}{c(A)c(B)}$,该反应为放热反应(选填“吸热”、“放热”).当反应达到平衡时,升高温度,A的转化率减小(选填“增大”、“减小”或“不变”).
(2)830℃时,向一个5L的密闭容器中充入0.20mol的A和0.80mol的B,如反应初始6s内A的平均反应速率v(A)=0.003mol/(L•s),则6s时c(A)=0.022mol/L,C的物质的量为0.09mol.
(3)一定条件下,向体积为2L的恒容密闭容器中充入1molA(g)和3molB(g),判断该反应达到平衡状态的依据是d.
a.c(A)=c(C) b.容器中压强不变
c.混合气体的平均相对分子质量不变 d.v逆(D)=v正(B)
(4)1200℃时反应C(g)+D(g)?A(g)+B(g)的平衡常数的值为2.5.
| 温度/℃ | 700 | 800 | 830 | 1000 | 1200 |
| 平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
(1)该反应的平衡常数表达式K=$\frac{c(C)c(D)}{c(A)c(B)}$,该反应为放热反应(选填“吸热”、“放热”).当反应达到平衡时,升高温度,A的转化率减小(选填“增大”、“减小”或“不变”).
(2)830℃时,向一个5L的密闭容器中充入0.20mol的A和0.80mol的B,如反应初始6s内A的平均反应速率v(A)=0.003mol/(L•s),则6s时c(A)=0.022mol/L,C的物质的量为0.09mol.
(3)一定条件下,向体积为2L的恒容密闭容器中充入1molA(g)和3molB(g),判断该反应达到平衡状态的依据是d.
a.c(A)=c(C) b.容器中压强不变
c.混合气体的平均相对分子质量不变 d.v逆(D)=v正(B)
(4)1200℃时反应C(g)+D(g)?A(g)+B(g)的平衡常数的值为2.5.