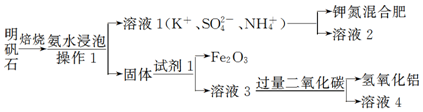
题目内容
11.下列仪器都不能用酒精灯直接加热的是( )①烧杯 ②坩埚 ③蒸发皿 ④试管 ⑤蒸馏烧瓶 ⑥锥形瓶 ⑦燃烧匙.
| A. | ③⑥⑦ | B. | ①⑤⑥ | C. | ②③⑤ | D. | ④⑤⑥⑦ |
分析 实验室中可直接加热的仪器有蒸发皿、试管、坩埚,垫石棉网可加热的有烧杯、烧瓶、锥形瓶等,不能加热的有集气瓶、广口瓶、细口瓶等,以此解答该题.
解答 解:①烧杯、⑤蒸馏烧瓶 ⑥锥形瓶底部面积较大,为防止加热不均匀而炸裂,可间接加热,加热时需垫石棉网,而②坩埚、③蒸发皿、④试管、⑦燃烧匙可直接加热.
故选B.
点评 本题考查仪器的加热,为高频考点,侧重考查学生的分析、实验能力,注意实验室中一些仪器可以直接加热,有些需垫石棉网,有些根本就不能被加热.烧杯、烧瓶不能直接加热,需垫石棉网,较简单.

练习册系列答案
 全能练考卷系列答案
全能练考卷系列答案
相关题目
13.硫酸铵是化工、染织、医药、皮革等工业原料.某硫酸工厂利用副产品Y处理尾气SO2得到CaSO4,再与相邻的合成氨工厂联合制备(NH4)2SO4,工艺流程如图:
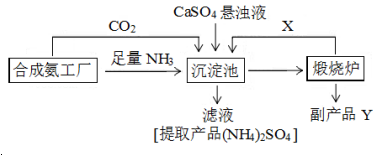
请回答以下问题:
(1)下列有关(NH4)2SO4溶液的说法正确的是
A.电离方程式:(NH4)2SO4?2NH4++SO42-
B.水解离子方程式:NH4++H2O?NH3•H2O+H+
C.离子浓度关系:c(NH4+)+c(H+)═c(SO42-)+c(OH-)
D.微粒浓度大小:c(NH4+)>c(SO42-)>c(H+)>c(NH3•H2O)>c(OH-)
(2)硫酸工业中,V2O5作催化剂时发生反应2SO2+O2?2SO3,SO2的转化率与温度、压强有关,请根据下表信息,结合工业生产实际,选择表中最合适的温度和压强分别是420℃、1.01×105Pa.该反应420℃时的平衡常数>520℃时的平衡常数(填“>”、“<”或“=”).
(3)在2L密闭容器中模拟接触法制备三氧化硫时,若第12分钟恰好达到平衡,测得生成SO3的物质的量为1.2mol,计算前12分钟用氧气表示反应速率v(O2)为0.025mol/(L.min).
(4)副产品Y是氧化钙.沉淀池中发生的主要反应方程式是CaSO4+CO2+2NH3+H2O→CaCO3↓+(NH4)2SO4.
(5)从绿色化学和资源综合利用的角度说明上述流程的主要优点是产生的CO2循环使用,物质充分利用,副产品有用,无污染性物质产生.

请回答以下问题:
(1)下列有关(NH4)2SO4溶液的说法正确的是
A.电离方程式:(NH4)2SO4?2NH4++SO42-
B.水解离子方程式:NH4++H2O?NH3•H2O+H+
C.离子浓度关系:c(NH4+)+c(H+)═c(SO42-)+c(OH-)
D.微粒浓度大小:c(NH4+)>c(SO42-)>c(H+)>c(NH3•H2O)>c(OH-)
(2)硫酸工业中,V2O5作催化剂时发生反应2SO2+O2?2SO3,SO2的转化率与温度、压强有关,请根据下表信息,结合工业生产实际,选择表中最合适的温度和压强分别是420℃、1.01×105Pa.该反应420℃时的平衡常数>520℃时的平衡常数(填“>”、“<”或“=”).
 | 1.01×105Pa | 5.05×105Pa | 1.01×106Pa |
| 420℃ | 0.9961 | 0.9972 | 0.9984 |
| 520℃ | 0.9675 | 0.9767 | 0.9852 |
| 620℃ | 0.8520 | 0.8897 | 0.9276 |
(4)副产品Y是氧化钙.沉淀池中发生的主要反应方程式是CaSO4+CO2+2NH3+H2O→CaCO3↓+(NH4)2SO4.
(5)从绿色化学和资源综合利用的角度说明上述流程的主要优点是产生的CO2循环使用,物质充分利用,副产品有用,无污染性物质产生.
10.向含amolBa(OH)2和amolNaOH的混合液中通入bmolCO2,下列说法不正确的是( )
| A. | 当a=b时,发生的离子总反应为:Ba2++2OH-+CO2═BaCO3↓+H2O | |
| B. | 当3a≤2b时发生的离子反应为:OH-+CO2═HCO3- | |
| C. | 当2a=b时,发生的离子总反应为:Ba2++3OH-+2CO2═BaCO3↓+H2O+HCO3- | |
| D. | 2a<b<3a时,溶液中n(HCO3-)=(2b-3a)mol |
6.在一密闭容器中有HCHO、H2和O2混合气体共20g,放入足量Na2O2用电火 花引燃,使其完全反应,Na2O2增重8g,则原混合气体中HCHO、H2和O2的质量比可能是( )
| A. | 1:3:6 | B. | 2:1:6 | C. | 3:5:12 | D. | 1:1:6 |
3.已知碳氢化合物完全燃烧生成CO2和H2O,25°C和101kpa时,C4H8、C2H4和C3H8组成的混合烃20mL与过量氧气混合并完全燃烧,生成二氧化碳和水蒸气.除去水蒸气,恢复到原来的温度和压强,气体的总体积缩小了50mL,原混合烃中C2H4的体积分数为( )
| A. | 75% | B. | 50% | C. | 5% | D. | 12.5% |
20.如图用石墨电极电解CuCl2溶液.下列分析正确的是( )
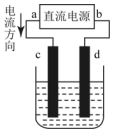

| A. | c极发生还原反应 | B. | 每生成6.4gCu,转移电子0.2mol | ||
| C. | 阳极反应式:Cu2++2e→Cu | D. | 在溶液中电子由d流向c |