题目内容
13.下列说法正确的是( )| A. | 氮原子的质量就是氮的相对原子质量 | |
| B. | 氦气的摩尔质量是8g•mol-1 | |
| C. | 1molH2SO4中含1molH2 | |
| D. | 1molH2O的质量是18g |
分析 A.质量和相对原子质量的单位不同;
B.氦气是单原子分子;
C.H2SO4中不含氢气;
D.水的摩尔质量是18g/mol,带入m=nM计算.
解答 解:A.质量的单位是g,相对原子质量的单位是“1”,故A错误;
B.氦气的摩尔质量是4g•mol-1,故B错误;
C.1molH2SO4中含2molH,故C错误;
D.H2O的摩尔质量是18g/mol,1molH2O的质量m=1mol×18g/mol=18g,故D正确;
故选D.
点评 本题考查了摩尔质量的有关知识,难度不大,易错选项是C,明确分子中含有原子不能含有分子.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
4.雾霾天气肆虐给人类健康带来了严重影响.燃煤和汽车尾气是造成空气污染的原因之一.
(1)汽车尾气净化的主要原理为:
2NO(g)+2CO$?_{加热}^{催化剂}$2CO2(g)+N2(g)△H<O
①该反应的速率时间罔像如图中左图所示.若其他条件不变,仅在反应前加入合适的催化剂,其速率时间图象如图中右图所示.以下说法正确的是BC(填对应字母).
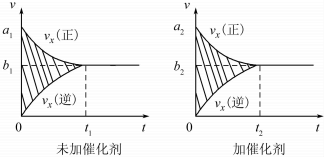
A.a1>a2,B.b1<b2 C.t1>t2 D.右图中阴影部分面积更大 E.左图中阴影部分面积更大
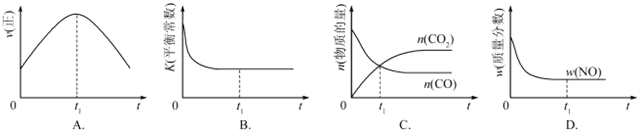
②若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是BD(填代号).
(2)直接排放煤燃烧产生的烟气会引起严重的环境问题.煤燃烧产生的烟气含氮的氧化物,用CH4催化还原NOx可以消除氮氧化物的污染.
已知:CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(g)△H=-867kJ/mol
2NO2(g)═N2O4(g)△H=-56.9kJ/mol H2O(g)=H2O(l)△H=-44.0kJ/mol
写出CH4催化还原N2O4(g)生成N2和H2O(l)的热化学方程式:CH4(g)+N2O4(g)═N2(g)+2H2O(l)+CO2(g)△H=-898.1kJ/mol.
(3)CH4和H2O(g) 在催化剂表面发生反应CH4+H2O?CO+3H2,该反应在不同温度下的化学平衡常数如下表:
①该反应是吸热反应(填“吸热”或“放热”).
②T℃时,向1L密闭容器中投人l mol CH4和l mol H2O(g),平衡时c(CH4)=0.5mol/L,该温度下反应CH4+H2O═CO+3H2的平衡常数K=6.75.
(4)甲烷燃料电池可以提升能量利用率.如图是利用甲烷燃料电池电解100ml1mol/L食盐水,电解一段时间后,收集到标准状况下的氢气2.24L(设电解后溶液体积不变).
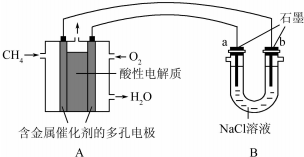
①甲烷燃料电池的负极反应式:CH4-8e-+2H2O=CO2+8H+
②电解后溶液的pH=14(忽略氯气与氢氧化钠溶液反应)
③阳极产生气体的体积在标准状况下是1.68L.
(1)汽车尾气净化的主要原理为:
2NO(g)+2CO$?_{加热}^{催化剂}$2CO2(g)+N2(g)△H<O
①该反应的速率时间罔像如图中左图所示.若其他条件不变,仅在反应前加入合适的催化剂,其速率时间图象如图中右图所示.以下说法正确的是BC(填对应字母).

A.a1>a2,B.b1<b2 C.t1>t2 D.右图中阴影部分面积更大 E.左图中阴影部分面积更大
②若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是BD(填代号).

(2)直接排放煤燃烧产生的烟气会引起严重的环境问题.煤燃烧产生的烟气含氮的氧化物,用CH4催化还原NOx可以消除氮氧化物的污染.
已知:CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(g)△H=-867kJ/mol
2NO2(g)═N2O4(g)△H=-56.9kJ/mol H2O(g)=H2O(l)△H=-44.0kJ/mol
写出CH4催化还原N2O4(g)生成N2和H2O(l)的热化学方程式:CH4(g)+N2O4(g)═N2(g)+2H2O(l)+CO2(g)△H=-898.1kJ/mol.
(3)CH4和H2O(g) 在催化剂表面发生反应CH4+H2O?CO+3H2,该反应在不同温度下的化学平衡常数如下表:
| 温度/℃ | 800 | 1000 | 1200 | 1400 |
| 平衡常数 | 0.45 | 1.92 | 276.5 | 1771.5 |
②T℃时,向1L密闭容器中投人l mol CH4和l mol H2O(g),平衡时c(CH4)=0.5mol/L,该温度下反应CH4+H2O═CO+3H2的平衡常数K=6.75.
(4)甲烷燃料电池可以提升能量利用率.如图是利用甲烷燃料电池电解100ml1mol/L食盐水,电解一段时间后,收集到标准状况下的氢气2.24L(设电解后溶液体积不变).

①甲烷燃料电池的负极反应式:CH4-8e-+2H2O=CO2+8H+
②电解后溶液的pH=14(忽略氯气与氢氧化钠溶液反应)
③阳极产生气体的体积在标准状况下是1.68L.
1.关于下列四个图象的说法中正确的是( )


| A. | 图①表示将SO2气体通入溴水中溶液PH值随SO2气体变化关系 | |
| B. | 图②表示反应N2(g)+3H2($?_{催化剂}^{高温、高压}$g)2NH3(g)△H<0的平衡常数K随温度的变化 | |
| C. | 图③中阴、阳两极收集到的气体体积之比一定为1:1 | |
| D. | 图④中的△H1<△H2 |
18.下列关于反应热的说法正确的是( )
| A. | 当△H为“-”时,表示该反应为吸热反应 | |
| B. | 化学反应的反应热只与反应体系的始态和终态有关,而与反应的途径无关 | |
| C. | H2S的燃烧热△H=-a kJ•mol-1,则表示H2S燃烧热的热化学方程式为2H2S(g)+3O2(g)═2SO2(g)+2H2O(l)△H=-2a kJ•mol-1 | |
| D. | 反应热的大小与反应物所具有的能量和生成物所具有的能量无关 |
5.下表列出了除去物质中所含少量杂质的方法,其中不正确的是( )
| 选项 | 物质 | 所含杂质 | 除去杂质的方法 |
| A | N2 | O2 | 将气体缓缓通过足量的灼热铜网 |
| B | NaCl | KNO3 | 冷却热饱和溶液,过滤 |
| C | Cu | Zn | 加入足量稀盐酸,充分反应后过滤,洗涤,干燥 |
| D | FeCl2溶液 | CuCl2 | 加入足量铁粉,充分反应后过滤 |
| A. | A | B. | B | C. | C | D. | D |
2.下列变化中,需加人适当的氧化剂才能完成的是( )
| A. | Fe→FeCl2 | B. | CuO→Cu | C. | Cl2→HCl | D. | SO3→H2SO4 |
3.硅及其化合物是带来人类文明的重要物质.下列说法正确的是( )
| A. | 陶瓷、水晶、水泥、玻璃都属于硅酸盐 | |
| B. | 水玻璃是纯净物,可用于生产黏合剂和防火剂 | |
| C. | 某硅酸盐的化学式为KAlSi3O8,可用K2O.Al2 O3.6SiO2表示 | |
| D. | 高纯硅可用于制造光导纤维,高纯二氧化硅可用于制造太阳能电池 |

 A、B、C、D、E、F都是周期表中前四周期的元素,它们的核电荷数依次增大,其中A、B、C、D、E为不同主族的元素.A、C的最外层电子数都是其电子层数的2倍,B的电负性大于C,透过蓝色钴玻璃观察E的焰色反应为紫色,F的基态原子中有4个未成对电子.
A、B、C、D、E、F都是周期表中前四周期的元素,它们的核电荷数依次增大,其中A、B、C、D、E为不同主族的元素.A、C的最外层电子数都是其电子层数的2倍,B的电负性大于C,透过蓝色钴玻璃观察E的焰色反应为紫色,F的基态原子中有4个未成对电子. .
.