��Ŀ����
4������������Ű�����ཡ������������Ӱ�죮ȼú������β������ɿ�����Ⱦ��ԭ��֮һ����1������β����������Ҫԭ��Ϊ��
2NO��g��+2CO$?_{����}^{����}$2CO2��g��+N2��g����H��O
�ٸ÷�Ӧ������ʱ��������ͼ����ͼ��ʾ���������������䣬���ڷ�Ӧǰ������ʵĴ�����������ʱ��ͼ����ͼ����ͼ��ʾ������˵����ȷ����BC�����Ӧ��ĸ����
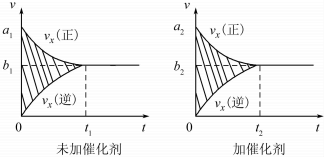
A��a1��a2��B��b1��b2 C��t1��t2 D����ͼ����Ӱ����������� E����ͼ����Ӱ�����������
�����÷�Ӧ�ھ��ȡ����ݵ��ܱ���ϵ�н��У�����ʾ��ͼ��ȷ����˵����Ӧ�ڽ��е�t1ʱ�̴ﵽƽ��״̬����BD������ţ���
��2��ֱ���ŷ�úȼ�ղ������������������صĻ������⣮úȼ�ղ����������������������CH4����ԭNOx�������������������Ⱦ��
��֪��CH4��g��+2NO2��g���TN2��g��+CO2��g��+2H2O��g����H=-867kJ/mol
2NO2��g���TN2O4��g����H=-56.9kJ/mol H2O��g��=H2O��l����H=-44.0kJ/mol
д��CH4����ԭN2O4��g������N2��H2O��l�����Ȼ�ѧ����ʽ��CH4��g��+N2O4��g���TN2��g��+2H2O��l��+CO2��g����H=-898.1kJ/mol��
��3��CH4��H2O��g�� �ڴ������淢����ӦCH4+H2O?CO+3H2���÷�Ӧ�ڲ�ͬ�¶��µĻ�ѧƽ�ⳣ�����±���
| �¶�/�� | 800 | 1000 | 1200 | 1400 |
| ƽ�ⳣ�� | 0.45 | 1.92 | 276.5 | 1771.5 |
��T��ʱ����1L�ܱ�������Ͷ��l mol CH4��l mol H2O��g����ƽ��ʱc��CH4��=0.5mol/L�����¶��·�ӦCH4+H2O�TCO+3H2��ƽ�ⳣ��K=6.75��
��4������ȼ�ϵ�ؿ����������������ʣ���ͼ�����ü���ȼ�ϵ�ص��100ml1mol/Lʳ��ˮ�����һ��ʱ����ռ�����״���µ�����2.24L���������Һ������䣩��
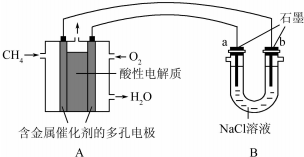
�ټ���ȼ�ϵ�صĸ�����Ӧʽ��CH4-8e-+2H2O=CO2+8H+
�ڵ�����Һ��pH=14����������������������Һ��Ӧ��
�������������������ڱ�״������1.68L��
���� ��1���ټ�����������淴Ӧ���ʶ����ﵽƽ������ʱ����٣���ƽ�ⲻ�ƶ���
��A������ƽ���������������ȣ����ٱ仯��
B������ƽ����¶�Ϊ��ֵ��ƽ�ⳣ�����䣬��Ϸ�Ӧ���ж��淴Ӧ�����������¶ȱ仯���ж��¶ȶԻ�ѧƽ�ⳣ����Ӱ�죻
C��t1ʱ�̺������̼��CO�����ʵ��������仯������ٱ仯��
D������ƽ������ֵĺ����������仯��
��2�����ݸ�˹���ɣ�����֪�Ȼ�ѧ����ʽ�����ʵ���ϵ�����мӼ�����Ŀ���Ȼ�ѧ����ʽ��
��3�����¶����ߣ�ƽ�ⳣ������ƽ��������Ӧ�����ƶ���
��T��ʱ����1L�ܱ�������Ͷ��1molCH4��1mol H2O��g����ƽ��ʱc��CH4��=0.5mol•L-1������ƽ��Ũ�ȣ����ƽ�ⳣ���ı���ʽ���㣻
��4����ԭ��ظ�������������Ӧ�������ڸ���ͨ�룬���������£�����������Ӧ����CO2��H+��
�ڸ��ݵ���Ȼ�����Һ�ĵ�ⷽ��ʽ������Һ��PH��
�۵������У�����������������֮����ˮ�������������������������������ʵ����ж�������������������ʵ�����Ȼ����������µ�������������������
��� �⣺��1���ټ�����������淴Ӧ���ʶ����ﵽƽ������ʱ����٣���ƽ�ⲻ�ƶ�����ͼ����Ӱ����������䣬�ʴ�Ϊ��BC��
��A������ƽ���������������ȣ����ٱ仯��t1ʱ��V�����֮���淴Ӧ�������ʷ����仯��δ����ƽ�⣬��A����
B���÷�Ӧ����ӦΪ���ȷ�Ӧ���淴Ӧ�����¶����ߣ���ѧƽ�ⳣ����С������ƽ����¶�Ϊ��ֵ������ߣ�ƽ�ⳣ�����䣬Ϊ��С��ͼ����ʵ�ʷ��ϣ���B��ȷ��
C��t1ʱ�̺������̼��CO�����ʵ��������仯��t1ʱ��δ����ƽ��״̬����C����
D��NO����������Ϊ��ֵ��t1ʱ�̴���ƽ��״̬����D��ȷ��
�ʴ�Ϊ��BD��
��2����֪��CH4��g��+2NO2��g���TN2��g��+CO2��g��+2H2O��g����H1=-867kJ/mol��
2NO2��g��?N2O4��g����H2=-56.9kJ/mol��
H2O��g��=H2O��l����H=-44.0kJ/mol��
���ݸ�˹���ɣ���-��+�ܡ�2�ɵ�CH4��g��+N2O4��g��=N2��g��+CO2��g��+2H2O��l�����ʡ�H=-867kJ/mol-��-56.9kJ/mol��+2��-44.0��kJ/mol=-898.1kJ/mol ��CH4��g��+N2O4��g���TN2��g��+2H2O��l��+CO2��g����H=-898.1kJ/mol��
�ʴ�Ϊ��CH4��g��+N2O4��g���TN2��g��+2H2O��l��+CO2��g����H=-898.1kJ/mol��
��3�����¶����ߣ�ƽ�ⳣ������ƽ��������Ӧ�����ƶ����ʸ÷�ӦΪ���ȷ�Ӧ��
�ʴ�Ϊ�����ȣ�
��T��ʱ����1L�ܱ�������Ͷ��1molCH4��1mol H2O��g����ƽ��ʱc��CH4��=0.5mol•L-1�����¶�K=$\frac{c��CO��•{c}^{3}��{H}_{2}��}{c��C{H}_{4}��•c��{H}_{2}O��}$=$\frac{0.5��1��{5}^{3}}{0.5��0.5}$=6.75��
�ʴ�Ϊ��6.75��
��4���١�ԭ��ظ�������������Ӧ�������ڸ���ͨ�룬���������£�����������Ӧ����CO2��H+�������缫��ӦʽΪ��CH4-8e-+2H2O=CO2+8H+��
�ʴ�Ϊ��CH4-8e-+2H2O=CO2+8H+��
��100mL 1mol/Lʳ��ˮ�к����Ȼ���0.1mol�����ݷ�Ӧ����ʽ2NaCl+2H2O$\frac{\underline{\;���\;}}{\;}$2NaOH+H2��+Cl2����֪�����0.1molNaCl����0.1mol�������ƺ�0.05mol������ͬʱ����0.05mol�������������ʵ��Ϊ���ˮ�������2.24L���������ʵ���Ϊ0.1mol�����ˮ����0.05mol����������0.025mol���������������������ܹ�����0.075mol���壬
������ɱ����2.24L����ʱ��NaCl��ȫ��⣬����0.1molNaOH����Һ���Ϊ0.1L����c��OH-��=1mol/L��c��H+��=10-14������PH=14��
�ʴ�Ϊ��14��
�۸��ݢڵķ�����֪��������������������0.05mol������0.025mol�������ܹ�����0.075mol���壬��״��������������������Ϊ��22.4L/mol��0.075mol=1.68L��
�ʴ�Ϊ��1.68��
���� ���⿼���˻�ѧƽ�ⳣ��Ӱ�����ؼ����㡢���ԭ�����Ȼ�ѧ����ʽ����д��֪ʶ����Ŀ�ѶȽϴ������漰��֪ʶ��϶࣬���������ѧ���ķ�����������������ѧ����������ע�����ջ�ѧƽ�ⳣ���ĸ������ʽ����Ӱ�����أ���ȷ���ԭ�����ܹ���ȷ��д�缫��Ӧʽ��

| A�� | �ȼҵ�ǵ�����ڵ�NaCl����������Cl2 | |
| B�� | ����ȼ�ϵ�ؿɽ�����ֱ��ת��Ϊ���� | |
| C�� | ԭ��ع���ʱ�����ӴӸ��������·�������� | |
| D�� | ��ҵ�ϵ�����ڵ�AlCl3����ȡ�� |
| A�� | �������м���Ũ�������ַ�������˵��Ũ���������ˮ�� | |
| B�� | Ũ�����ڹ�������ɫ��ƣ�˵��Ũ����ȶ� | |
| C�� | �����£�Ũ����������������棬˵������Ũ�����Ӧ | |
| D�� | ���ˮ�еμ�CCl4�����ú�ֲ㣬CCl4����Ϻ�ɫ��˵������CCl4�ӵ�ˮ����ȡ�� |
����֪��2CO��g��+O2��g���T2CO2��g����H=-566kJ/mol
2Fe��s��+$\frac{3}{2}$O2��g���TFe2O3��s����H=-825.5kJ/mol
��Ӧ��Fe2O3��s��+3CO��g��?2Fe��s��+3CO2��g����H=-23.5kJ/mol��
��Ӧ$\frac{1}{3}$Fe2O3��s��+CO��g��?$\frac{2}{3}$Fe��s��+CO2��g����1000���ƽ�ⳣ������4.0����һ���ݻ�Ϊ10L���ܱ������У�1000��ʱ����Fe��Fe2O3��CO��CO2��1.0mol����Ӧ����10min��ﵽƽ�⣮
��1��CO��ƽ��ת����=60%��
��2�������CO��ƽ��ת���ʣ��ٽ�Fe2O3��ת�����ɲ�ȡ�Ĵ�ʩ��d
a����߷�Ӧ�¶� b������Ӧ��ϵ��ѹǿ
c��ѡȡ���ʵĴ��� d����ʱ���ջ��Ƴ�����CO2
e�������ʯ��ʹ����ƽ���������ֽӴ�
��1����¯���������ķ����е�CO�ɽ��л��գ�ʹ����һ�������º�H2��Ӧ�Ʊ��״���
CO��g��+2H2��g��?CH3OH��g���������ͼʾ�ش��������⣺
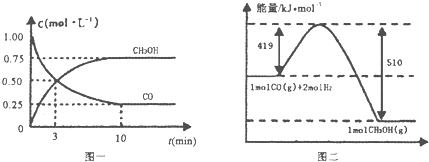
��1���ӷ�Ӧ��ʼ��ƽ�⣬��H2Ũ�ȱ仯��ʾƽ����Ӧ����v��H2��=0.15mol/��L•min����
��2�������¶Ⱥ��ݻ���ͬ�������ܱ������У�����ͬ��ʽͶ�뷴Ӧ���÷�Ӧ�ﵽƽ�ⅼ���й��������±���
| ���� | ��Ӧ��Ͷ����� | ��Ӧ���ת���� | CH3OH��Ũ�� | �����仯 ��Q1��Q2��Q3������0�� |
| �� | 1mol CO��2mol H2 | a1 | c1 | �ų�Q1kJ���� |
| �� | 1mol CH3OH | a2 | c2 | ����Q2kJ���� |
| �� | 2mol CO��4mol H2 | a3 | c3 | �ų�Q3kJ���� |
A c1=c2B.2Q1=Q3C.2a1=a3D��a1+a2=1E���÷�Ӧ������1mol CH3OH����ų���Q1+Q2��kJ������
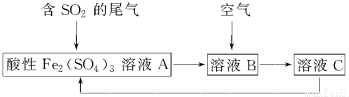
| A�� | ��ҺB�з����ķ�ӦΪ2SO2+O2�T2SO3 | |
| B�� | �������Ը��������Һ������ҺC���Ƿ���Fe3+ | |
| C�� | ���������̿���֪�����ԣ�Fe3+��O2��SO42- | |
| D�� | �˹��յ��ŵ�֮һ��������ѭ������ |
| A�� | �������ͭ�������л���ʱ��Ҳ����ֹ�������� | |
| B�� | �ڿ����н���������Ѹ�ٱ������γɱ���Ĥ | |
| C�� | ��˿��Ũ�����ڳ����¶ۻ� | |
| D�� | ������ϡH2SO4��Ӧʱ���Ӽ���CuSO4��Һ���ɼӿ�H2�IJ��� |
| A�� | ��ԭ�ӵ��������ǵ������ԭ������ | |
| B�� | ������Ħ��������8g•mol-1 | |
| C�� | 1molH2SO4�к�1molH2 | |
| D�� | 1molH2O��������18g |
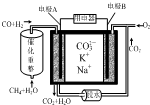
| A�� | �缫AΪ�����������˻�ԭ��Ӧ | |
| B�� | �缫A��CO����ĵ缫��ӦΪ��CO+O2--2e-�TCO2 | |
| C�� | �缫B�Ϸ����ĵ缫��ӦΪ��O2+2CO2+4e-�T2CO32- | |
| D�� | ��ع���ʱ��K+��缫A�ƶ� |