题目内容
1.关于下列四个图象的说法中正确的是( )
| A. | 图①表示将SO2气体通入溴水中溶液PH值随SO2气体变化关系 | |
| B. | 图②表示反应N2(g)+3H2($?_{催化剂}^{高温、高压}$g)2NH3(g)△H<0的平衡常数K随温度的变化 | |
| C. | 图③中阴、阳两极收集到的气体体积之比一定为1:1 | |
| D. | 图④中的△H1<△H2 |
分析 A.溴水溶液呈酸性,pH<7;
B.温度升高平衡向逆反应方向移动,K减小;
C.铁做阳极,为活性电极,电极本身放电;
D.依据盖斯定律解答.
解答 解:A.溴水溶液呈酸性,反应为Br2+H20═HBr+HBr0,pH<7,与图象中的pH>7不符,故A错误;
B.反应N2(g)+3H2(g)?2NH3(g),△H<0,反应放热,温度升高平衡向逆反应方向移动,K减小,故B错误;
C.铁做阳极,为活性电极,电极本身放电,阳极不会产生气体,故C错误;
D.根据盖斯定律可知△H1=△H2+△H3,由于反应都放热,则△H<0,故△H1<△H2,故D正确;
故选:D.
点评 本题为图象题,涉及溴水与二氧化硫反应、平衡移动、电解以及盖斯定律等问题,题目难度中等,注意对基础知识的巩固.

练习册系列答案
 学习实践园地系列答案
学习实践园地系列答案
相关题目
11.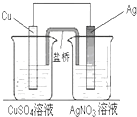 用铜片、银片、CuSO4溶液、AgNO3溶液、导线和盐桥(装有琼脂-KNO3的U形管)构成一个原电池(如图).以下有关该原电池的叙述正确的是 ( )
用铜片、银片、CuSO4溶液、AgNO3溶液、导线和盐桥(装有琼脂-KNO3的U形管)构成一个原电池(如图).以下有关该原电池的叙述正确的是 ( )
①在外电路中,电子由铜电极流向银电极
②正极反应为:Ag++e-═Ag
③盐桥中K+移向CuSO4溶液
④将铜片浸入AgNO3溶液中发生的化学反应与该原电池总反应相同.
 用铜片、银片、CuSO4溶液、AgNO3溶液、导线和盐桥(装有琼脂-KNO3的U形管)构成一个原电池(如图).以下有关该原电池的叙述正确的是 ( )
用铜片、银片、CuSO4溶液、AgNO3溶液、导线和盐桥(装有琼脂-KNO3的U形管)构成一个原电池(如图).以下有关该原电池的叙述正确的是 ( )①在外电路中,电子由铜电极流向银电极
②正极反应为:Ag++e-═Ag
③盐桥中K+移向CuSO4溶液
④将铜片浸入AgNO3溶液中发生的化学反应与该原电池总反应相同.
| A. | ①② | B. | ③④ | C. | ①②④ | D. | ①②③④ |
12.我国是个钢铁大国,钢铁产量为世界第一,高炉炼铁是最为普遍的炼铁方法.
Ⅰ.已知:2CO(g)+O2(g)═2CO2(g)△H=-566kJ/mol
2Fe(s)+$\frac{3}{2}$O2(g)═Fe2O3(s)△H=-825.5kJ/mol
反应:Fe2O3(s)+3CO(g)?2Fe(s)+3CO2(g)△H=-23.5kJ/mol.
Ⅱ.反应$\frac{1}{3}$Fe2O3(s)+CO(g)?$\frac{2}{3}$Fe(s)+CO2(g)在1000℃的平衡常数等于4.0.在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0mol,反应经过10min后达到平衡.
(1)CO的平衡转化率=60%.
(2)欲提高CO的平衡转化率,促进Fe2O3的转化,可采取的措施是d
a.提高反应温度 b.增大反应体系的压强
c.选取合适的催化剂 d.及时吸收或移出部分CO2
e.粉碎矿石,使其与平衡混合气体充分接触
Ⅲ.(1)高炉炼铁产生的废气中的CO可进行回收,使其在一定条件下和H2反应制备甲醇:
CO(g)+2H2(g)?CH3OH(g).请根据图示回答下列问题:
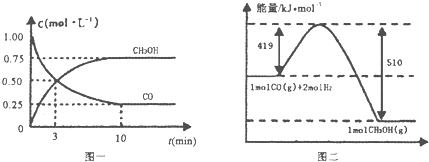
(1)从反应开始到平衡,用H2浓度变化表示平均反应速率v(H2)=0.15mol/(L•min).
(2)若在温度和容积相同的三个密闭容器中,按不同方式投入反应物,测得反应达到平衡吋的有关数据如下表:
则下列关系正确的是ADE.
A c1=c2B.2Q1=Q3C.2a1=a3D.a1+a2=1E.该反应若生成1mol CH3OH,则放出(Q1+Q2)kJ热量.
Ⅰ.已知:2CO(g)+O2(g)═2CO2(g)△H=-566kJ/mol
2Fe(s)+$\frac{3}{2}$O2(g)═Fe2O3(s)△H=-825.5kJ/mol
反应:Fe2O3(s)+3CO(g)?2Fe(s)+3CO2(g)△H=-23.5kJ/mol.
Ⅱ.反应$\frac{1}{3}$Fe2O3(s)+CO(g)?$\frac{2}{3}$Fe(s)+CO2(g)在1000℃的平衡常数等于4.0.在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0mol,反应经过10min后达到平衡.
(1)CO的平衡转化率=60%.
(2)欲提高CO的平衡转化率,促进Fe2O3的转化,可采取的措施是d
a.提高反应温度 b.增大反应体系的压强
c.选取合适的催化剂 d.及时吸收或移出部分CO2
e.粉碎矿石,使其与平衡混合气体充分接触
Ⅲ.(1)高炉炼铁产生的废气中的CO可进行回收,使其在一定条件下和H2反应制备甲醇:
CO(g)+2H2(g)?CH3OH(g).请根据图示回答下列问题:

(1)从反应开始到平衡,用H2浓度变化表示平均反应速率v(H2)=0.15mol/(L•min).
(2)若在温度和容积相同的三个密闭容器中,按不同方式投入反应物,测得反应达到平衡吋的有关数据如下表:
| 容器 | 反应物投入的量 | 反应物的转化率 | CH3OH的浓度 | 能量变化 (Q1,Q2,Q3均大于0) |
| 甲 | 1mol CO和2mol H2 | a1 | c1 | 放出Q1kJ热量 |
| 乙 | 1mol CH3OH | a2 | c2 | 吸收Q2kJ热量 |
| 丙 | 2mol CO和4mol H2 | a3 | c3 | 放出Q3kJ热量 |
A c1=c2B.2Q1=Q3C.2a1=a3D.a1+a2=1E.该反应若生成1mol CH3OH,则放出(Q1+Q2)kJ热量.
9.如图所示是一种综合处理SO2废气的工艺流程,若每步都完全反应.下列说法正确的是( )
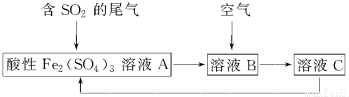

| A. | 溶液B中发生的反应为2SO2+O2═2SO3 | |
| B. | 可用酸性高锰酸钾溶液检验溶液C中是否含有Fe3+ | |
| C. | 由以上流程可推知氧化性:Fe3+>O2>SO42- | |
| D. | 此工艺的优点之一是物质能循环利用 |
16.下列变化中属于原电池反应的是( )
| A. | 铁表面镀铜,表面有划损时,也能阻止铁被氧化 | |
| B. | 在空气中金属铝表面迅速被氧化形成保护膜 | |
| C. | 铁丝与浓硫酸在常温下钝化 | |
| D. | 在铁与稀H2SO4反应时,加几滴CuSO4溶液,可加快H2的产生 |
6. 已知:CO(g)+2H2(g)?CH3OH(l)△H=-248kJ/mol,蒸发1mol CH3OH(l)需要吸收的能量为157kJ,相关数据如下
已知:CO(g)+2H2(g)?CH3OH(l)△H=-248kJ/mol,蒸发1mol CH3OH(l)需要吸收的能量为157kJ,相关数据如下
一定条件下,在体积1L的密闭容器中加入1mol CO(g)和2mol H2(g)充分反应,生成CH3OH(g)放出热量Q kJ,下列说法正确的是( )
 已知:CO(g)+2H2(g)?CH3OH(l)△H=-248kJ/mol,蒸发1mol CH3OH(l)需要吸收的能量为157kJ,相关数据如下
已知:CO(g)+2H2(g)?CH3OH(l)△H=-248kJ/mol,蒸发1mol CH3OH(l)需要吸收的能量为157kJ,相关数据如下| H2(g) | CO(g) | CH3OH(g) | |
| 1mol分子中的化学键形成时要释放出的能量/kJ | 436 | 1084 | a |
| A. | 上图可表示合成甲醇过程中的能量变化 | |
| B. | a的数值为2047 | |
| C. | Q的数值为91 | |
| D. | 其它条件相同,反应使用催化剂时释放出的能量大于无催化剂时释放出的能量 |
13.下列说法正确的是( )
| A. | 氮原子的质量就是氮的相对原子质量 | |
| B. | 氦气的摩尔质量是8g•mol-1 | |
| C. | 1molH2SO4中含1molH2 | |
| D. | 1molH2O的质量是18g |
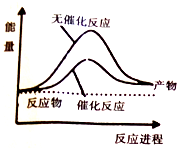
11.H2O2在催化剂作用下分解速率加快,其能量随反应进程的变化如图所示,下列说法正确的是( )
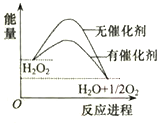

| A. | 元素O的单质存在O2和O3两种同位素 | |
| B. | 加入催化剂,减小了H2O2分解反应的热效应 | |
| C. | 若H2O2分解产生1molO2,理论上转移4mol电子 | |
| D. | H2O2和Na2O2所含化学键类型不同 |
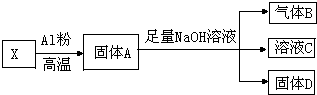 某同学设计实验将Fe3O4和CuO组成的混合物X进行如图所示的转化(每一步均反应完全)
某同学设计实验将Fe3O4和CuO组成的混合物X进行如图所示的转化(每一步均反应完全)