题目内容
12.温度为500℃时,反应4NH3+5O2?4NO+6H2O在5L的密闭容器中进行,半分钟后NO的物质的量增加了0.3mol,则此反应的平均速率$\overline{v}$(x)为( )| A. | $\overline{v}$(O2)=0.01mol/(L•s) | B. | $\overline{v}$(NO)=0.08mol/(L•s) | ||
| C. | $\overline{v}$(H2O)=0.0013mol/(L•s) | D. | $\overline{v}$(NH3)=0.002mol/(L•s) |
分析 根据v(NO)=$\frac{\frac{△n}{V}}{△t}$计算NO的反应速率,再根据同一可逆反应中,同一时间段内,各种物质的反应速率之比等于其计量数之比计算其它气体的反应速率.
解答 解:v(NO)=$\frac{\frac{△n}{V}}{△t}$=$\frac{\frac{0.3mol}{5L}}{30s}$=0.002mol/(L•s),
A.v(O2)=$\frac{5}{4}$v(NO)=$\frac{5}{4}$×0.002 mol/(L•s)=0.0025mol/(L•s),故A错误;
B.v(NO)=$\frac{\frac{△n}{V}}{△t}$=$\frac{\frac{0.3mol}{5L}}{30s}$=0.002 mol/(L•s),故B错误;
C.v(H2O)=$\frac{3}{2}$v(NO)=$\frac{3}{2}$×0.002mol/(L•s)=0.003 mol/(L•s),故C错误;
D.v(NH3)=v(NO)=0.002ol/(L•s),故D正确;
故选D.
点评 本题考查了化学反应速率的计算,明确同一可逆反应中同一时间段内各种物质的反应速率与其计量数之间的关系是解本题关键,灵活运用公式来分析解答,难度不大.

练习册系列答案
相关题目
13.胡椒酚是植物挥发油的成分之一.它的结构式为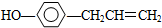 ,下列叙述中正确的是( )
,下列叙述中正确的是( )
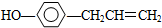 ,下列叙述中正确的是( )
,下列叙述中正确的是( )| A. | 1mol胡椒酚最多可与4mol氢气发生反应 | |
| B. | 1mol胡椒酚最多可与2mol溴发生反应 | |
| C. | 与FeCl3显紫色,因为该物质与苯酚属于同系物 | |
| D. | 胡椒酚在水中的溶解度大于苯酚在水中的溶解度 |
7. 某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:
某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:
①将碱式滴定管用蒸馏水洗净后,用待测溶液润洗后,再注入待测溶液,调节滴定管的尖嘴部分充满溶液,并使液面处于“0“刻度的位置;将锥形瓶用蒸馏水洗净后,用待测溶液润洗锥形瓶2~3次;从碱式滴定管中放入25.00mL待测溶液到锥形瓶中.
②将酸式滴定管用蒸馏水洗净后,立即向其中注入0.1000mol/L标准盐酸,调节滴定管的尖嘴部分充满溶液,并使液面处于“0“刻度或“0“刻度以下的某一位置.
③向锥形瓶中滴入酚酞作指示剂,进行滴定.滴定至溶液刚好变色,测得盐酸的体积为V1mL.
④重复以上过程两次,测得所耗盐酸的体积分别为V2mL、V3mL.试回答下列问题:
(1)锥形瓶中的溶液从红色变为无色时,停止滴定.
(2)滴定时边滴边摇动锥形瓶,眼睛应观察B
A、滴定管内液面的变化 B、锥形瓶内溶液颜色的变化
(3)该小组在步骤①中的错误是待测溶液润洗锥形瓶,由此造成的测定结果偏高(偏高、偏低或无影响)
(4)步骤②缺少的操作是未用标准液润洗酸式滴定管由此造成的测定结果偏高(偏高、偏低或无影响)
(5)如图,是某次滴定时的滴定管中的液面,其读数为22.60mL
(6)根据下列数据:
请计算待测烧碱溶液的浓度:0.0800mol/L.
 某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:
某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:①将碱式滴定管用蒸馏水洗净后,用待测溶液润洗后,再注入待测溶液,调节滴定管的尖嘴部分充满溶液,并使液面处于“0“刻度的位置;将锥形瓶用蒸馏水洗净后,用待测溶液润洗锥形瓶2~3次;从碱式滴定管中放入25.00mL待测溶液到锥形瓶中.
②将酸式滴定管用蒸馏水洗净后,立即向其中注入0.1000mol/L标准盐酸,调节滴定管的尖嘴部分充满溶液,并使液面处于“0“刻度或“0“刻度以下的某一位置.
③向锥形瓶中滴入酚酞作指示剂,进行滴定.滴定至溶液刚好变色,测得盐酸的体积为V1mL.
④重复以上过程两次,测得所耗盐酸的体积分别为V2mL、V3mL.试回答下列问题:
(1)锥形瓶中的溶液从红色变为无色时,停止滴定.
(2)滴定时边滴边摇动锥形瓶,眼睛应观察B
A、滴定管内液面的变化 B、锥形瓶内溶液颜色的变化
(3)该小组在步骤①中的错误是待测溶液润洗锥形瓶,由此造成的测定结果偏高(偏高、偏低或无影响)
(4)步骤②缺少的操作是未用标准液润洗酸式滴定管由此造成的测定结果偏高(偏高、偏低或无影响)
(5)如图,是某次滴定时的滴定管中的液面,其读数为22.60mL
(6)根据下列数据:
| 滴定次数 | 待测液体积(mL) | 标准盐酸体积(mL) | |
| 滴定前读数(mL) | 滴定后读数(mL) | ||
| 第一次 | 25.00 | 0.00 | 19.90 |
| 第二次 | 25.00 | 0.00 | 20.00 |
| 第三次 | 25.00 | 4.00 | 24.10 |
17.据报道,科学家新合成了一种抗癌、治癌的药物,其化学式可表示为10B20.下列叙述正确的是( )
| A. | 10B20为硼元素的一种原子 | B. | 10B20为硼元素的一种单质 | ||
| C. | 10B的中子数比核外电子数多 | D. | 10B的原子核外电子排布为 |
4.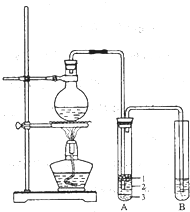 某化学兴趣小组的同学为制取少量溴乙烷,查阅资料得知:
某化学兴趣小组的同学为制取少量溴乙烷,查阅资料得知:
NaBr+H2SO4→HBr+NaHSO4
CH3CH2OH+HBr$\stackrel{△}{→}$CH3CH2Br+H2O
化学兴趣小组根据实验原理设计如图的装置.
根据题意完成下列填空:有关数据列表如下:
(1)圆底烧瓶中加入的反应物是溴化钠、乙醇和2:1的硫酸.配制体积比2:1的硫酸所用的仪器为abc选填编号)
a.烧杯 b.玻璃棒 c.量筒 d.容量瓶 e.滴定管
(2)将生成物导入盛有冰水混合物的试管A中,试管A中的物质分为三层(如图所示),产物在第3层;
(3)用浓的硫酸进行实验,若试管A中获得的有机物呈棕黄色,除去其中杂质应加入d选填编号)然后再进行分液一步操作即可;
a.无水氯化钙 b.硝酸银溶液 c.四氯化碳 d.亚硫酸钠溶液
(4)实验过程中,同学发现仪器连接部分有漏气现象,老师建议把上述装置中的仪器连接部分都改成标准玻璃接口,其原因是:反应会产生Br2,腐蚀橡胶;
(5)假设最初取用的无水乙醇是57.5mL,最后得到的纯净的溴乙烷是52.0mL,则溴乙烷的产率为66.8%.
 某化学兴趣小组的同学为制取少量溴乙烷,查阅资料得知:
某化学兴趣小组的同学为制取少量溴乙烷,查阅资料得知:NaBr+H2SO4→HBr+NaHSO4
CH3CH2OH+HBr$\stackrel{△}{→}$CH3CH2Br+H2O
化学兴趣小组根据实验原理设计如图的装置.
根据题意完成下列填空:有关数据列表如下:
| 乙醇 | 溴乙烷 | |
| 状态 | 无色液体 | 无色液体 |
| 密度/g•cm-3 | 0.8 | 1.4 |
| 沸点/℃ | 78.5 | 119.0 |
| 熔点/℃ | -l30 | 38.4 |
a.烧杯 b.玻璃棒 c.量筒 d.容量瓶 e.滴定管
(2)将生成物导入盛有冰水混合物的试管A中,试管A中的物质分为三层(如图所示),产物在第3层;
(3)用浓的硫酸进行实验,若试管A中获得的有机物呈棕黄色,除去其中杂质应加入d选填编号)然后再进行分液一步操作即可;
a.无水氯化钙 b.硝酸银溶液 c.四氯化碳 d.亚硫酸钠溶液
(4)实验过程中,同学发现仪器连接部分有漏气现象,老师建议把上述装置中的仪器连接部分都改成标准玻璃接口,其原因是:反应会产生Br2,腐蚀橡胶;
(5)假设最初取用的无水乙醇是57.5mL,最后得到的纯净的溴乙烷是52.0mL,则溴乙烷的产率为66.8%.
1.关于下列各装置图的叙述中,正确的是( )
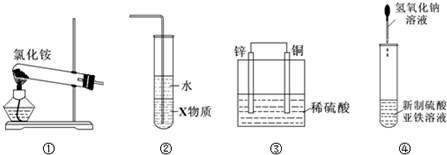

| A. | 实验室用装置①制取氨气 | |
| B. | 装置②中X若为四氯化碳,可用于吸收氨气,并防止倒吸 | |
| C. | 装置③是原电池,锌电极为负极,发生还原反应 | |
| D. | 装置④可用于制备氢氧化亚铁并观察其颜色 |
 如图表示800℃时A、B、C三种气体物质的浓度随时间变化的情况,试回答:
如图表示800℃时A、B、C三种气体物质的浓度随时间变化的情况,试回答: