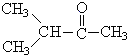
题目内容
14.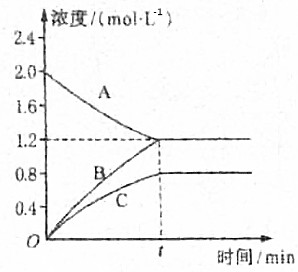 如图表示800℃时A、B、C三种气体物质的浓度随时间变化的情况,试回答:
如图表示800℃时A、B、C三种气体物质的浓度随时间变化的情况,试回答:(1)该反应的反应物是A.
(2)该反应是否为可逆反应?是,原因是反应进行到tmin后ABC物质的量浓度不变,反应达到化学平衡,该反应的化学方程式为2A?3B+2C.
(3)若t时刻是2min,则A物质的平均反应速率为0.4mol/(L•min).
分析 (1)随反应进行,反应物的浓度降低,生成物的浓度增大,据此结合图象判断.
(2)根据浓度变化量之比等于化学计量数之比确定化学计量数,t时刻反应达到平衡状态,为可逆反应,据此书写方程式.
(4)由图可知△c(A)=2.0mol/L-1.2mol/L=0.8mol/L,根据v=$\frac{△c}{△t}$计算A物质的平均反应速率.
解答 解:(1)由图可知,随反应进行A的浓度降低,A为反应物,B、C的浓度增大,故B、C为生成物.
故答案为:A.
(2)图象分析可知,由图可知随时间增长到t时刻后,ABC物质的量浓度不再随时间变化,说明反应达到平衡状态,反应为可逆反应,
△c(A)=2.0mol/L-1.2mol/L=0.8mol/L,△c(C)=0.8mol/L,△c(B)=1.2mol/L,A、B、C化学计量数之比等于浓度变化量之比为0.8mol/L:1.2mol/L:0.8mol/L=2:3:2,反应为可逆反应,故反应方程式为2A?3B+2C.
故答案为:是;反应进行到tmin后ABC物质的量浓度不变,反应达到化学平衡;2A?3B+2C.
(3)由图可知△c(A)=2.0mol/L-1.2mol/L=0.8mol/L,所v(A)=$\frac{0.8mol/L}{2min}$=0.4mol/(L•min).
故答案为:0.4mol/(L•min).
点评 考查化学反应速率、浓度-时间图象等,注重基础,旨在考查学生对基础知识的掌握,题目难度不大.

练习册系列答案
 阳光课堂课时优化作业系列答案
阳光课堂课时优化作业系列答案
相关题目
5.下列叙述正确的是( )
| A. | 装置Ⅰ在反应过程中自始至终只生成红棕色气体 | |
| B. | 装置Ⅱ开始阶段铁丝只发生析氢腐蚀 | |
| C. | 装置Ⅱ在反应过程中能产生氢气 | |
| D. | 装置Ⅰ在反应结束时溶液中的金属阳离子只有Cu2+ |
2.烯烃、炔烃、芳香烃和乙醛都能发生加成反应.这是因为它们都含有( )
| A. | 单键 | B. | 不饱和碳原子 | C. | 非极性键 | D. | 碳原子 |
9.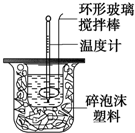 利用如图装置测定中和反应的反应热的实验步骤如下:
利用如图装置测定中和反应的反应热的实验步骤如下:
①用量筒量取50mL 0.25mol/L硫酸倒入小烧杯中,测出硫酸溶液温度;
②用另一量筒量取50mL 0.55mol/L NaOH溶液,并测出其温度;
③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测出混合液最高温度.
回答下列问题:
(1)写出稀硫酸和氢氧化钠溶液反应表示中和热的热反应化学方程(中和热数值为57.3KJ/mol)NaOH(aq)+$\frac{1}{2}$H2SO4(aq)=$\frac{1}{2}$Na2SO4(aq)+H2O(l)△H=-57.3kJ/mol
(2)使硫酸与NaOH溶液混合均匀的正确操作是D
A.用温度计小心搅拌 B.揭开硬纸片用玻璃棒搅拌
C.轻轻地振荡烧杯 D.用套在温度计上的环形玻璃棒轻轻地搅动
(3)实验数据如下表:
①温度差平均值为3.4℃.近似认为0.55mol/L NaOH溶液和0.25mol/L硫酸溶液的密度都是1g/cm3,中和后生成溶液的比热容c=4.18J/(g•℃).利用上表数据计算该中和反应的反应热△H=-56.8kJ/mol( 保留一位小数);
②利用上表数据计算出的中和热与57.3kJ/mol有偏差,产生偏差的原因可能是(填字母)abcd.
a.实验装置保温、隔热效果差; b.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度;
c.量取NaOH溶液的体积时仰视读数; d.分多次把NaOH溶液倒入盛有硫酸的小烧杯中.
 利用如图装置测定中和反应的反应热的实验步骤如下:
利用如图装置测定中和反应的反应热的实验步骤如下:①用量筒量取50mL 0.25mol/L硫酸倒入小烧杯中,测出硫酸溶液温度;
②用另一量筒量取50mL 0.55mol/L NaOH溶液,并测出其温度;
③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测出混合液最高温度.
回答下列问题:
(1)写出稀硫酸和氢氧化钠溶液反应表示中和热的热反应化学方程(中和热数值为57.3KJ/mol)NaOH(aq)+$\frac{1}{2}$H2SO4(aq)=$\frac{1}{2}$Na2SO4(aq)+H2O(l)△H=-57.3kJ/mol
(2)使硫酸与NaOH溶液混合均匀的正确操作是D
A.用温度计小心搅拌 B.揭开硬纸片用玻璃棒搅拌
C.轻轻地振荡烧杯 D.用套在温度计上的环形玻璃棒轻轻地搅动
(3)实验数据如下表:
| 温度 实验次数 | 起始温度t1℃ | 终止温度t2/℃ | 温度差平均值 (t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 29.5 | 3.4 |
| 2 | 25.9 | 25.9 | 25.9 | 29.2 | |
| 3 | 26.4 | 26.2 | 26.3 | 29.8 | |
②利用上表数据计算出的中和热与57.3kJ/mol有偏差,产生偏差的原因可能是(填字母)abcd.
a.实验装置保温、隔热效果差; b.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度;
c.量取NaOH溶液的体积时仰视读数; d.分多次把NaOH溶液倒入盛有硫酸的小烧杯中.
19.《后汉书•郡国志》中记载:“石出泉水…其水有肥,燃之极明,不可食,县人谓之石漆.”《酉阳杂俎》一书:“高奴县石脂水,水腻,浮上如漆,采以膏车及燃灯极明.”这里的“石漆”“石脂水”是指( )
| A. | 油脂 | B. | 油漆 | C. | 石油 | D. | 煤焦油 |
6.下列说法属于苯和甲苯都具有的性质是( )
| A. | 分子中所有原子都在同一平面内 | |
| B. | 能与溴水发生加成反应使其褪色 | |
| C. | 能与浓HNO3在一定条件下发生取代反应 | |
| D. | 能与酸性KMnO4溶液反应使其褪色 |
12.温度为500℃时,反应4NH3+5O2?4NO+6H2O在5L的密闭容器中进行,半分钟后NO的物质的量增加了0.3mol,则此反应的平均速率$\overline{v}$(x)为( )
| A. | $\overline{v}$(O2)=0.01mol/(L•s) | B. | $\overline{v}$(NO)=0.08mol/(L•s) | ||
| C. | $\overline{v}$(H2O)=0.0013mol/(L•s) | D. | $\overline{v}$(NH3)=0.002mol/(L•s) |
13.下列说法中不正确的是( )
| A. | 铜丝燃烧法可确定有机物中是否存在氮、氯和硫等元素 | |
| B. | 减压分馏、常压分馏都是物理变化 | |
| C. | 甲烷与氯气在光照条件下反应是一个自由基型链反应 | |
| D. | 液化石油气、天然气都是混合物 |
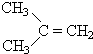 $→_{Zn/H_{2}O_{2}}^{O_{3}}$
$→_{Zn/H_{2}O_{2}}^{O_{3}}$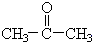 +
+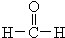 据以上线索和下列反应事实,确定C7H14的结构和名称:C7H14$→_{Zn/H_{2}O_{2}}^{O_{3}}$CH3CHO+
据以上线索和下列反应事实,确定C7H14的结构和名称:C7H14$→_{Zn/H_{2}O_{2}}^{O_{3}}$CH3CHO+