题目内容
2.向20mL某物质的量浓度的AlCl3溶液中滴入2mol/L NaOH溶液时,得到的Al(OH)3沉淀的质量与所滴加的NaOH溶液的体积(mL)关系如图所示,试回答下列问题:
(1)图中A点表示的意义是Al3+完全沉淀;
(2)图中B点表示的意义是Al(OH)3刚好完全溶解;
(3)假如溶液中生成了沉淀0.39g,则此时用去NaOH溶液的体积最少是7.5mL或17.5mL.(写出计算过程)
分析 根据发生的反应为AlCl3+3NaOH═Al(OH)3↓+3NaCl、Al(OH)3+NaOH═NaAlO2+2H2O,结合图象来分析,
(1)由图象可知,0~A发生AlCl3+3NaOH═Al(OH)3↓+3NaCl;
(2)由图象可知A~B发生Al(OH)3+NaOH═NaAlO2+2H2O;
(3)溶液中有Al(OH)3沉淀存在两种情况,只发生AlCl3+3NaOH═Al(OH)3↓+3NaCl;若发生AlCl3+3NaOH═Al(OH)3↓+3NaCl、Al(OH)3+NaOH═NaAlO2+2H2O;
解答 解:(1)由图象可知,0~A发生AlCl3+3NaOH═Al(OH)3↓+3NaCl,A点时Al3+完全沉淀,故答案为:Al3+完全沉淀;
(2)由图象可知A~B发生Al(OH)3+NaOH═NaAlO2+2H2O,则B点时Al(OH)3刚好完全溶解,故答案为:Al(OH)3刚好完全溶解;
(3)溶液中有Al(OH)3沉淀0.39g,n=$\frac{0.39g}{78g/mol}$=0.005mol,存在两种情况,则
①只发生AlCl3+3NaOH═Al(OH)3↓+3NaCl,设此时用去NaOH溶液体积为x,则$\frac{0.005mol×3}{2mol/L}$
=0.0075L=7.5mL,
②若发生AlCl3+3NaOH═Al(OH)3↓+3NaCl、Al(OH)3+NaOH═NaAlO2+2H2O,则$\frac{0.01mol×3+0.005mol}{2mol/L}$
=0.0175L=17.5mL,
故答案为:7.5mL或17.5mL.
点评 本题考查氯化铝与碱的反应,明确发生的化学反应及反应与图象的对应关系是解答本题的关键,难度不大.

练习册系列答案
 期末集结号系列答案
期末集结号系列答案
相关题目
12.温度为500℃时,反应4NH3+5O2?4NO+6H2O在5L的密闭容器中进行,半分钟后NO的物质的量增加了0.3mol,则此反应的平均速率$\overline{v}$(x)为( )
| A. | $\overline{v}$(O2)=0.01mol/(L•s) | B. | $\overline{v}$(NO)=0.08mol/(L•s) | ||
| C. | $\overline{v}$(H2O)=0.0013mol/(L•s) | D. | $\overline{v}$(NH3)=0.002mol/(L•s) |
13.下列说法中不正确的是( )
| A. | 铜丝燃烧法可确定有机物中是否存在氮、氯和硫等元素 | |
| B. | 减压分馏、常压分馏都是物理变化 | |
| C. | 甲烷与氯气在光照条件下反应是一个自由基型链反应 | |
| D. | 液化石油气、天然气都是混合物 |
17.下列气体不会造成大气污染的是( )
| A. | 氯气 | B. | 一氧化氮 | C. | 一氧化碳 | D. | 氮气 |
14.X、Y、Z、R、W是原子序数依次增大的五种短周期元素.Y和R同主族,可组成共价化合物RY2,Y和Z最外层电子数之和与W的最外层电子数相同. X和W形成化合物的水溶液为强酸.下列说法不正确的是( )
| A. | Y、Z、W三种元素组成化合物的化学式可能为ZWY | |
| B. | Z与Y、Z与W形成的化合物的化学键类型可能完全相同 | |
| C. | 简单离子的半径:R>W>Y>Z | |
| D. | 因非金属性Y>R,所以X与Y组成化合物的沸点低于X与R组成的化合物 |
12.下列比较错误的是( )
| A. | 原子半径:N>O>F | B. | 酸性强弱:H2SO4>H2SiO3>H2CO3 | ||
| C. | 碱性强弱:KOH>NaOH>Mg(OH)2 | D. | 氢化物的稳定性:HF>HCl>H2S |
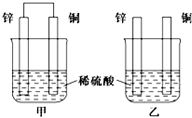 (1)将纯锌片和纯铜片按如图方式插入相同浓度的稀硫酸中一段时间,回答下列问题:
(1)将纯锌片和纯铜片按如图方式插入相同浓度的稀硫酸中一段时间,回答下列问题: