题目内容
18.化合物A为一种常见金属元素与一种常见非金属元素组成的化合物,阳离子与阴离子的个数比为2:3.K为常见固态非金属单质,J为常见气态单质.其余为化合物,其中I、F在常温下为液态,C为有臭鸡蛋气味气体、D为刺激性气体,H无色无味气体,B为白色胶状沉淀,L为氯碱工业中的常见产品.F的浓溶液与K加热可生成D和H.(部分生成物未标出)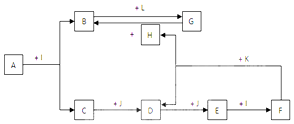
(1)写出H的电子式
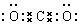 .
.(2)写出下列物质的化学式:ESO3,JO2.
(3)写出下列变化的化学方程式:
A+I→B+CAl2S3+6H2O=2Al(OH)3↓+3H2S↓;
F的浓溶液与K加热可生成D和HC+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O.
(4)写出下列变化的离子方程式:
B中加入L的水溶液Al(OH)3+OH-=AlO2-+2H2O;
G的水溶液中通入过量的HAlO2-+CO2+H2O=Al(OH)3↓+HCO3-.
分析 F的浓溶液与常见固态非金属单质K加热可生成刺激性气体D和无色无味气体H.中学里符合该反应的只有碳跟浓硫酸或与浓硝酸反应,即K为碳,C与J连续反应得到E,E与液体I反应得到F,可推知J为O2,I为H2O,离子化合物A在水中发生水解反应得到B与C,C为有臭鸡蛋气味气体为H2S,B为白色胶状沉淀,L为氯碱工业中的常见产品,二者反应得到G,可推知B为Al(OH)3,L为NaOH、G为NaAlO2,则F为浓硫酸符合图中的物质间转化,C为H2S,D为SO2,E为SO3,H为CO2,A为一种Al与S组成的化合物,根据阳离子与阴离子的个数比为2:3,即可得知A为Al2S3,据此解答.
解答 解:F的浓溶液与常见固态非金属单质K加热可生成刺激性气体D和无色无味气体H.中学里符合该反应的只有碳跟浓硫酸或与浓硝酸反应,即K为碳,C与J连续反应得到E,E与液体I反应得到F,可推知J为O2,I为H2O,离子化合物A在水中发生水解反应得到B与C,C为有臭鸡蛋气味气体为H2S,B为白色胶状沉淀,L为氯碱工业中的常见产品,二者反应得到G,可推知B为Al(OH)3,L为NaOH、G为NaAlO2,则F为浓硫酸符合图中的物质间转化,C为H2S,D为SO2,E为SO3,H为CO2,A为一种Al与S组成的化合物,根据阳离子与阴离子的个数比为2:3,即可得知A为Al2S3,
(1)H是二氧化碳,是碳原子和两个氧原子分别形成两对共用电子对形成的共价化合物,二氧化碳的电子式为: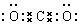 ,
,
故答案为: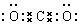 ;
;
(2)分析可知E为SO3,J为O2,
故答案为:SO3;O2;
(3)A+I→B+C是硫化铝在水溶液中发生双水解生成氢氧化铝沉淀和硫化氢气体,反应的化学方程式为:Al2S3+6H2O=2Al(OH)3↓+3H2S↓,F的浓溶液与K加热可生成D和H是碳和浓硫酸加热反应生成二氧化碳、二氧化硫和水,反应的化学方程式为:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O,
故答案为:Al2S3+6H2O=2Al(OH)3↓+3H2S↓;C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O;
(4)B中加入L的水溶液的反应是氢氧化铝和强碱反应生成偏铝酸盐,反应的离子方程式为:Al(OH)3+OH-=AlO2-+2H2O,G的水溶液中通入过量的H是偏铝酸盐溶液中通入过量二氧化碳生成氢氧化铝沉淀,反应的离子方程式为:AlO2-+CO2+H2O=Al(OH)3↓+HCO3-,
故答案为:Al(OH)3+OH-=AlO2-+2H2O; AlO2-+CO2+H2O=Al(OH)3↓+HCO3-.
点评 本题考查无机物推断,该题突破口是:C为有臭鸡蛋气味气体,F的浓溶液与常见固态非金属单质K加热可生成刺激性气体D和无色无味气体H,再结合题目信息及转化关系推断,需要学生熟练掌握元素化合物性质,题目难度中等.

| A. | Ba(OH)2、Na2SO3、FeCl3、KCl | B. | Na2SiO3、Na2CO3、KNO3、NH4Cl | ||
| C. | NH3•H2O、H3PO4、Na2SO4、H2SO4 | D. | NaHCO3、C6H5COOH、C2H5OH、HCl |
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 向FeBr2溶液中通入少量Cl2 | 溶液由浅绿色变为黄色 | 氧化性:Cl2>Br2 |
| B | 向Na2SO3溶液中滴加盐酸 | 有气体产生 | 非金属性:Cl>S |
| C | 向pH=3的HA和HB溶液中分别加水稀释至100倍 | pH(HA)>pH(HB) | 酸性:HA>HB |
| D | 向重晶石中加入饱和碳酸钠溶液 | 重晶石逐渐溶解 | 溶度积:Ksp(BaCO3)<Ksp(BaSO4) |
| A. | A | B. | B | C. | C | D. | D |
| A. | 将Cl2通入氯化亚铁溶液 Fe2++Cl2=Fe3++2Cl- | |
| B. | 向FeBr2溶液中通入足量氯气:2Fe2++4Br-+3Cl2=2 Fe3++2 Br2+6 Cl | |
| C. | 少量Ca(HCO3)2溶液与过量NaOH溶液反应:HCO3-+Ca2++OH-=CaCO3↓+H2O | |
| D. | 铜与浓硝酸的反应:Cu+4HNO3=Cu 2++NO3-+2NO2↑+2H2O |
| A. | 常温常压下,44g CO2中含有2NA个π键 | |
| B. | 1mol•L-1NaCl溶液含有NA个Na+ | |
| C. | 0.5mol Cu和足量浓硝酸反应可以生成22.4LNO2 | |
| D. | 过量的液溴与铁反应,若反应中消耗1mol铁,则转移的电子数目为2NA个 |
| A. | 我国目前使用的主要能源仍是化石燃料,它属于不可再生能源 | |
| B. | 太阳能、氢能、风能、地热能、生物质能、沼气能等属于新能源 | |
| C. | 解决能源危机的根本途径是尽可能地节约能源,减少浪费 | |
| D. | 风能是太阳能的一种转换形式,所以风能属于二次能源 |
| A. | 常温常压下,11.2L NH3所含的原子数为2NA | |
| B. | 常温常压下,80g SO3含有的氧原子数为3NA | |
| C. | 标准状况下,22.4L H2中所含原子数为NA | |
| D. | 标准状况下,22.4L H2O中所含分子数为NA |
| A. | 氮气的化学性质不活泼,是因为氮元素不活泼 | |
| B. | 雷雨可以增加土壤中硝酸盐类氮肥的含量,此过程中的反应都属于氮的固定 | |
| C. | 氮气可替代稀有气体作焊接金属的保护气 | |
| D. | NO2溶于水生成硝酸,因此NO2是硝酸的酸酐 |