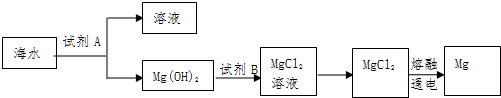
题目内容
3.X、Y、Z、Q、E五种元素中,X原子核外的M层中只有两对成对电子,Y原子核外的L层电子数是K层的两倍,Z是地壳内含量(质量分数)最高的元素,Q的核电荷数是X与Z的核电荷数之和,E在元素周期表的各元素中电负性最大.请回答下列问题:(1)X、Y的元素符号依次为S、C;
(2)Q的元素符号是Cr,它位于第四周期第ⅥB族,它的外围电子排布式为3d54s1,在形成化合物时它的最高化合价为+6;
(3)XZ2与YZ2分子的空间结构分别是V形和直线形,相同条件下两者在水中的溶解度较大的是SO2(写分子式),原因SO2是极性分子,H2O也是极性分子,相似相溶,而CO2是非极性分子.
(4)用氢键表示式写出E的氢化物溶液中存在的4种氢键F-H…F、O-H…O、O-H…F、F-H…O.
分析 X原子核外的M层中只有两对成对电子,核外电子排布应为1s22s22p63s23p4,则MS元素,Y原子核外的L层电子数是K层的两倍,Y有2个电子层,最外层电子数为4,故Y为C元素,Z是地壳内含量最高的元素,则ZO元素,Q的核电荷数是X与Z的核电荷数之和,Q原子序数为24,故Q为Cr元素,E在元素周期表的各元素中电负性最大,则E为F元素.
解答 解:X原子核外的M层中只有两对成对电子,核外电子排布应为1s22s22p63s23p4,则MS元素,Y原子核外的L层电子数是K层的两倍,Y有2个电子层,最外层电子数为4,故Y为C元素,Z是地壳内含量最高的元素,则ZO元素,Q的核电荷数是X与Z的核电荷数之和,Q原子序数为24,故Q为Cr元素,E在元素周期表的各元素中电负性最大,则E为F元素.
(1)由以上分析可知,X为S,Y为C,故答案为:S;C;
(2)Q为Cr,原子序数为24,位于周期表第四周期ⅥB族,核外电子排布式为1s22s22p63s23p63d54s1,外围电子排布式为,最高化合价为+6价,
故答案为:Cr;四、ⅥB;3d54s1;+6.
(3)SO2分子中S和O形成2个δ键,有1个孤电子对,空间构型为V形,CO2分子中C和O形成2个δ键,没有孤电子对,为直线形.SO2是极性分子,H2O也是极性分子,相似相溶,而CO2是非极性分子,故SO2在水中溶解度更大,
故答案为:V形;直线形;SO2;SO2是极性分子,H2O也是极性分子,相似相溶,而CO2是非极性分子;
(4)HF的水溶液中,HF分子之间形成氢键,可表示为H-F…H,水分子之间形成氢键,表示为O-H…O,HF分子与水分子之间形成氢键,HF中氟原子和水分子中的氢原子能形成氢键可表示为O-H…F,水中氧原子和氟化氢分子中的氢原子之间能形成氢键,可表示为 F-H…O,
故答案为:F-H…F、O-H…O、O-H…F、F-H…O.
点评 本题是对物质结构与性质的考查,涉及结构性质位置关系、核外电子排布、分子结构与性质、氢键等,题目难度中等,推断元素的种类是解题关键,注意掌握空间构型的判断.

 中考解读考点精练系列答案
中考解读考点精练系列答案| A. | 酸性溶液:Na+、NH4+、SO32-、NO3- | |
| B. | 滴加石蕊试剂呈红色的溶液:Na+、Al3+、SO42-、Cl- | |
| C. | 无色透明溶液:MnO4-、SO42-、K+、NO3- | |
| D. | 强碱性的溶液:Al3+、NH4+、Cl-、NO3- |
①增加反应物的浓度 ②升高温度 ③加入正催化剂 ④增大压强 ⑤将固体块状粉碎成粉末状.
| A. | ①②③④ | B. | ①②③⑤ | C. | ①②③ | D. | ②③④ |
| A. | 用品红溶液鉴别CO2和SO2 | |
| B. | 用湿润的pH试纸测稀碱液的pH | |
| C. | 用NaOH溶液液鉴别MgCl2和AlCl3溶液 | |
| D. | 用焰色反应鉴别NaCl和KCl |
| A. | 常温常压下测得1mol N2的质量为28 g | |
| B. | 用100mL量筒测得排水法收集制得的氢气体积为50.28mL | |
| C. | 用两个250mL的容量瓶配制0.1 mol/L 500 mL的NaOH溶液 | |
| D. | 用托盘天平称得2.50 g胆矾,受热充分失水后,固体质量减轻0.90g |
| A. | Mg2+、Ca2+、NO3-、Cl- | B. | Na+、Mg2+、Cl-、SO42- | ||
| C. | K+、Fe3+、Cl-、SO42- | D. | Ba2+、Al3+、Cl-、NO3- |
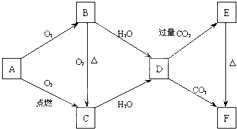 如图所示,A、B、C、D、E、F为金属钠或钠的化合物.
如图所示,A、B、C、D、E、F为金属钠或钠的化合物.