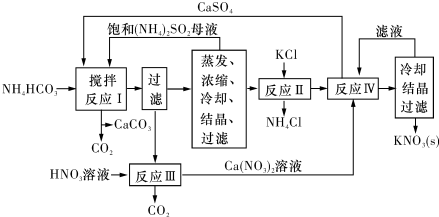
题目内容
15.下列各组物质中比值为2:1的是( )| A. | pH均为12的烧碱溶液与Ba(OH)2溶液的物质的量浓度之比 | |
| B. | (NH4)2SO4溶液中c(NH4+)与c(SO42-)之比 | |
| C. | 0.2mol/L的CH3COOH溶液与0.1mol/L和CH3COOH溶液中c(H+)之比 | |
| D. | 0.2mol/L的HCl与0.1mol/LHNO3溶液中n(H+)之比 |
分析 A.pH均为12的烧碱溶液与Ba(OH)2溶液中氢氧根离子浓度相等,结合化学式判断;
B.溶液中铵根离子水解;
C.醋酸溶液浓度越小,电离程度越大;
D.氢离子物质的量与溶液体积有关.
解答 解:A.pH均为12的烧碱溶液与Ba(OH)2溶液中氢氧根离子浓度相等,可知二者物质的量浓度之比为2:1,故A正确;
B.溶液中铵根离子水解,c(NH4+)与c(SO42-)之比小于2:1,故B错误;
C.醋酸溶液浓度越小,电离程度越大,0.2mol/L的CH3COOH溶液与0.1mol/L和CH3COOH溶液中c(H+)之比小于2:1,故C错误;
D.0.2mol/L的HCl与0.1mol/LHNO3溶液中氢离子浓度相等,但溶液体积未知,不能确定含有氢离子物质的量关系,故D错误,
故选:A.
点评 本题考查盐类水解、弱电解质的电离、物质的量浓度有关计算等,难度不大,注意对基础知识的理解掌握.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
14.下列实验操作不正确的是( )
| A. | 过滤时如果发现滤液是浑浊的,则滤液还要进行过滤 | |
| B. | 在进行蒸馏时,要加少量碎瓷片,防止液体暴沸 | |
| C. | 在进行分液操作时,分液漏斗内外气体相通,眼睛要注视烧杯中的溶液 | |
| D. | 在进行蒸馏时,温度计不要插入溶液中 |
6.下列离子方程式正确的是( )
| A. | 铁粉撒入稀硫酸中2Fe+6H+→2Fe3++3H2↑ | |
| B. | 向AlCl3溶液中加入过量的氨水:Al3++4NH3•H2O→AlO2-+4NH4++2H2O | |
| C. | 把金属钠放入冷水中:Na+H2O→Na++OH-+H2↑ | |
| D. | 用氢氧化钠溶液除去铝表面的氧化铝:Al2O3+2OH-→2AlO2-+H2O |
10.下列物质的分离(或提纯)方法错误的是( )
| A. | 除去氯化钠溶液中的泥沙--蒸发结晶 | |
| B. | 分离水和乙醇--蒸馏 | |
| C. | 用四氯化碳提取溴水中的溴单质--萃取 | |
| D. | 分离汽油和水--分液 |
7.下列实验中,所使用的装置(夹持装置略)、试剂和操作都正确的是( )
| A. | 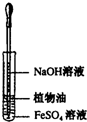 观察Fe(OH)2的生成 | B. | 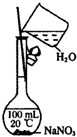 配制一定量浓度的NaNO3的溶液 | ||
| C. | 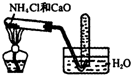 实验室制取氨气 | D. | 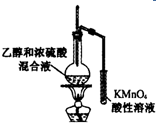 验证乙烯的生成 |
5.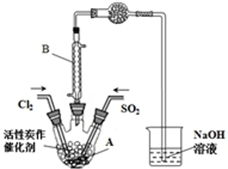 某学习小组依据反应:SO2(g)+Cl2(g)?SO2Cl2(g)△H<0,设计制备磺酰氯(SO2Cl2)的装置如图,有关信息如表所示.
某学习小组依据反应:SO2(g)+Cl2(g)?SO2Cl2(g)△H<0,设计制备磺酰氯(SO2Cl2)的装置如图,有关信息如表所示.
(1)若用浓盐酸与高锰酸钾为原料制取Cl2,则反应的离子方程式为2MnO4-+16H++10Cl-═2Mn2++5Cl2↑+8H2O;
(2)B仪器的作用是使挥发的产物SO2Cl2冷凝回流;
(3)为了便于混合物的分离且提高反应物的转化率,A装置的反应条件最好选择A;
A.冰水浴 B.常温 C.加热至69.1℃D.沸水浴
(4)实验时先通入干燥的Cl2将A装置中的空气赶走,再缓慢通入干燥的SO2,即发生反应.充分反应后,继续通入Cl2使装置中的SO2进入烧杯中被吸收.分离产物后,向获得的SO2Cl2中加水,出现白雾,振荡、静置得到无色溶液W.经分析SO2Cl2与H2O反应属于非氧化还原反应,写出该反应的化学方程式SO2Cl2+2H2O═H2SO4+2HCl;反应完成后,在W溶液、烧杯中分别滴加过量的BaCl2溶液,均出现白色沉淀,此沉淀不溶于稀盐酸,经过滤、洗涤、干燥,称量得到的固体质量分别为X g、Y g.计算SO2+Cl2?SO2Cl2反应中,SO2的转化率为(用含X、Y的代数式表示)$\frac{x}{x+y}$×100%.
 某学习小组依据反应:SO2(g)+Cl2(g)?SO2Cl2(g)△H<0,设计制备磺酰氯(SO2Cl2)的装置如图,有关信息如表所示.
某学习小组依据反应:SO2(g)+Cl2(g)?SO2Cl2(g)△H<0,设计制备磺酰氯(SO2Cl2)的装置如图,有关信息如表所示. | SO2Cl2 | Cl2 | SO2 | |
| 熔点/℃ | -54.1 | -101 | -72.4 |
| 沸点/℃ | 69.1 | -34.6 | -10 |
| 性质 | 遇水发生剧烈水解 | / | / |
(2)B仪器的作用是使挥发的产物SO2Cl2冷凝回流;
(3)为了便于混合物的分离且提高反应物的转化率,A装置的反应条件最好选择A;
A.冰水浴 B.常温 C.加热至69.1℃D.沸水浴
(4)实验时先通入干燥的Cl2将A装置中的空气赶走,再缓慢通入干燥的SO2,即发生反应.充分反应后,继续通入Cl2使装置中的SO2进入烧杯中被吸收.分离产物后,向获得的SO2Cl2中加水,出现白雾,振荡、静置得到无色溶液W.经分析SO2Cl2与H2O反应属于非氧化还原反应,写出该反应的化学方程式SO2Cl2+2H2O═H2SO4+2HCl;反应完成后,在W溶液、烧杯中分别滴加过量的BaCl2溶液,均出现白色沉淀,此沉淀不溶于稀盐酸,经过滤、洗涤、干燥,称量得到的固体质量分别为X g、Y g.计算SO2+Cl2?SO2Cl2反应中,SO2的转化率为(用含X、Y的代数式表示)$\frac{x}{x+y}$×100%.
 已知A、B、C、D、E、F都是周期表中前四周期的元素,且原子序数依次增大.A元素的阳离子核外无电子;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同,C与B同周期,核外有三个未成对电子;D元素的基态原子核外有8种运动状态的电子;E元素的最高正价与最低负价的代数和为4;F元素的正三价离子的3d轨道为半充满;请回答下列问题:
已知A、B、C、D、E、F都是周期表中前四周期的元素,且原子序数依次增大.A元素的阳离子核外无电子;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同,C与B同周期,核外有三个未成对电子;D元素的基态原子核外有8种运动状态的电子;E元素的最高正价与最低负价的代数和为4;F元素的正三价离子的3d轨道为半充满;请回答下列问题: