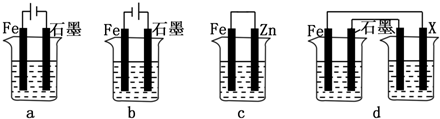
题目内容
7.下列实验中,所使用的装置(夹持装置略)、试剂和操作都正确的是( )| A. | 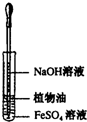 观察Fe(OH)2的生成 | B. | 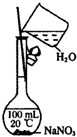 配制一定量浓度的NaNO3的溶液 | ||
| C. | 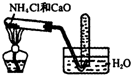 实验室制取氨气 | D. | 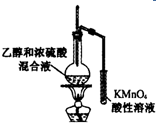 验证乙烯的生成 |
分析 A.氢氧化亚铁不稳定,易被空气中氧气氧化生成氢氧化铁,所以制备氢氧化亚铁要隔绝空气;
B.容量瓶只能配制溶液,不能作稀释或溶解药品的仪器;
C.氨气极易溶于水,不能采用排水法收集;
D.制取乙烯需要170℃,温度计测定混合溶液温度,且乙醇能被酸性高锰酸钾溶液氧化.
解答 解:A.氢氧化亚铁不稳定,易被空气中氧气氧化生成氢氧化铁,所以制备氢氧化亚铁要隔绝空气,植物油和水不互溶,且密度小于水,所以用植物油能隔绝空气,所以能实现实验目的,故A正确;
B.容量瓶只能配制溶液,不能作稀释或溶解药品的仪器,应该用烧杯溶解硝酸钠,然后等溶液冷却到室温,再将硝酸钠溶液转移到容量瓶中,故B错误;
C.实验室用氯化铵和氢氧化钙加热制取氨气,氨气极易溶于水,不能采用排水法收集,常温下,氨气和氧气不反应,且氨气密度小于空气,所以应该采用向下排空气法收集氨气,故C错误;
D.制取乙烯需要170℃,温度计测定混合溶液温度,所以温度计水银球应该插入溶液中,且乙醇能被酸性高锰酸钾溶液氧化,乙醇易挥发,导致得到的乙烯中含有乙醇,影响乙烯的检验,故D错误;
故选A.
点评 本题考查化学实验方案评价,为高频考点,涉及物质制备、物质检验、气体收集、溶液配制等知识点,明确实验原理及操作规范、物质性质是解本题关键,易错选项是D,知道常见气体的制备及收集方法,题目难度不大.

练习册系列答案
 发散思维新课堂系列答案
发散思维新课堂系列答案
相关题目
6.下列说法正确的是( )
| A. | 金属元素在不同的化合物中化合价均相同 | |
| B. | 所有合金都只含有金属元素 | |
| C. | 可利用铝热反应冶炼单质镁 | |
| D. | 镁合金的硬度和强度均高于纯镁 |
15.下列各组物质中比值为2:1的是( )
| A. | pH均为12的烧碱溶液与Ba(OH)2溶液的物质的量浓度之比 | |
| B. | (NH4)2SO4溶液中c(NH4+)与c(SO42-)之比 | |
| C. | 0.2mol/L的CH3COOH溶液与0.1mol/L和CH3COOH溶液中c(H+)之比 | |
| D. | 0.2mol/L的HCl与0.1mol/LHNO3溶液中n(H+)之比 |
2.下列说法错误的是( )
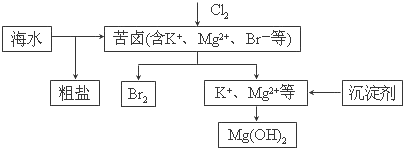

| A. | 向苦卤中通入Cl2是为了提取溴 | |
| B. | 粗盐可采用除杂和重结晶等过程提纯 | |
| C. | 工业生产中常选用NaOH作为沉淀剂 | |
| D. | 富集溴一般先用空气和水蒸气吹出单质溴,再用SO2将其氧化吸收 |
12.向300mL KOH溶液中缓慢通入2.24L(标准状况下)CO2气体,充分反应后,在减压蒸干溶液,得到11.9g白色固体.则下列说法中不正确的是( )
| A. | 此白色固体不可能是KHCO3和KOH的混合物 | |
| B. | 此白色固体中含有K2CO36.90g | |
| C. | 原KOH溶液的物质的量浓度是0.500 mol•L-1 | |
| D. | 此白色固体可能为KOH和K2CO3的混合物 |
19.下列表示对应化学反应或过程的离子方程式正确的是( )
| A. | 铜片插入硝酸银溶液中:Cu+Ag+═Cu2++Ag | |
| B. | 碳酸氢钙与过量的NaOH溶液反应:Ca2++2HCO3-+2OH-═CaCO3↓+2H2O+CO32- | |
| C. | 用稀硝酸除去试管内壁银:Ag+2H++NO3-═Ag++NO2↑+H2O | |
| D. | 向氨水中通入过量SO2:SO2+2NH3•H2O═2NH4++SO32-+H2O |
17. A、B、C、X均为中学化学常见物质,一定条件下它们有如下转化关系(其它产物已略去),下列说法正确的是( )
A、B、C、X均为中学化学常见物质,一定条件下它们有如下转化关系(其它产物已略去),下列说法正确的是( )
 A、B、C、X均为中学化学常见物质,一定条件下它们有如下转化关系(其它产物已略去),下列说法正确的是( )
A、B、C、X均为中学化学常见物质,一定条件下它们有如下转化关系(其它产物已略去),下列说法正确的是( )| A. | 若X为KOH溶液,则A可能为Al | |
| B. | 若A、B、C均为焰色反应呈黄色的化合物,则X一定为CO2 | |
| C. | 若X为O2,则A可为非金属单质硫 | |
| D. | 若X为Fe,则C可能为Fe(NO3)2溶液 |
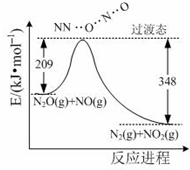 氨是合成硝酸、铵盐和氮肥的基本原料,回答下列问题:
氨是合成硝酸、铵盐和氮肥的基本原料,回答下列问题: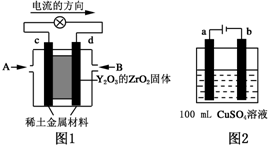 (1)科学家制造出一种使用固体电解质的燃料电池,其效率更高,可用于航空航天.如图1所示装置中,以稀土金属材料为惰性电极,在两极上分别通入CH4和空气,其中固体电解质是掺杂了Y2O3的ZrO2固体,它在高温下能传导阳极生成的O2-(O2+4e--→2O2-).
(1)科学家制造出一种使用固体电解质的燃料电池,其效率更高,可用于航空航天.如图1所示装置中,以稀土金属材料为惰性电极,在两极上分别通入CH4和空气,其中固体电解质是掺杂了Y2O3的ZrO2固体,它在高温下能传导阳极生成的O2-(O2+4e--→2O2-).