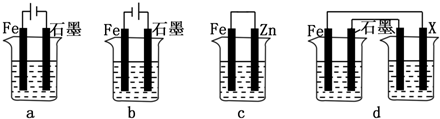
题目内容
5.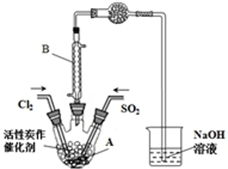 某学习小组依据反应:SO2(g)+Cl2(g)?SO2Cl2(g)△H<0,设计制备磺酰氯(SO2Cl2)的装置如图,有关信息如表所示.
某学习小组依据反应:SO2(g)+Cl2(g)?SO2Cl2(g)△H<0,设计制备磺酰氯(SO2Cl2)的装置如图,有关信息如表所示. | SO2Cl2 | Cl2 | SO2 | |
| 熔点/℃ | -54.1 | -101 | -72.4 |
| 沸点/℃ | 69.1 | -34.6 | -10 |
| 性质 | 遇水发生剧烈水解 | / | / |
(2)B仪器的作用是使挥发的产物SO2Cl2冷凝回流;
(3)为了便于混合物的分离且提高反应物的转化率,A装置的反应条件最好选择A;
A.冰水浴 B.常温 C.加热至69.1℃D.沸水浴
(4)实验时先通入干燥的Cl2将A装置中的空气赶走,再缓慢通入干燥的SO2,即发生反应.充分反应后,继续通入Cl2使装置中的SO2进入烧杯中被吸收.分离产物后,向获得的SO2Cl2中加水,出现白雾,振荡、静置得到无色溶液W.经分析SO2Cl2与H2O反应属于非氧化还原反应,写出该反应的化学方程式SO2Cl2+2H2O═H2SO4+2HCl;反应完成后,在W溶液、烧杯中分别滴加过量的BaCl2溶液,均出现白色沉淀,此沉淀不溶于稀盐酸,经过滤、洗涤、干燥,称量得到的固体质量分别为X g、Y g.计算SO2+Cl2?SO2Cl2反应中,SO2的转化率为(用含X、Y的代数式表示)$\frac{x}{x+y}$×100%.
分析 (1)浓盐酸与高锰酸钾发生反应生成MnCl2、KCl、Cl2、H2O;
(2)仪器B为冷凝管,起冷凝回流作用;
(3)正反应为放热反应,降低温度有利于SO2Cl2的生成,控制温度使SO2Cl2为液态,与未反应是氯气、二氧化硫分离;
(4)SO2Cl2遇水发生剧烈水解,且产生白雾,白雾是水解生成HCl与空气中水蒸气结合所致,则-SO2-基团结合2个-OH生成H2SO4;
无色溶液W为HCl、H2SO4混合溶液,除含少量OH-外,还含有Cl-、SO42-,W溶液中得到白色沉淀,是SO2Cl2水解生成H2SO4与BaCl2溶液反应生成的BaSO4,烧杯中白色沉淀是未反应的二氧化硫转化为硫酸钠,硫酸钠与BaCl2溶液反应生成的BaSO4,根据S元素守恒计算参加反应的二氧化硫物质的量、通入的二氧化硫总物质的量,进而计算SO2的转化率.
解答 解:(1)浓盐酸与高锰酸钾发生反应生成MnCl2、KCl、Cl2、H2O,反应的离子方程式为:2MnO4-+16H++10Cl-=2Mn2++5Cl2↑+8H2O,
故答案为:2MnO4-+16H++10Cl-=2Mn2++5Cl2↑+8H2O;
(2)SO2Cl2沸点低、易挥发,仪器B为冷凝管,使挥发的产物SO2Cl2冷凝回流,
故答案为:使挥发的产物SO2Cl2冷凝回流;
(3)正反应为放热反应,降低温度有利于SO2Cl2的生成,控制温度使SO2Cl2为液态,与未反应是氯气、二氧化硫分离,故选择冰水浴,
故答案为:A;
(4)SO2Cl2遇水发生剧烈水解,且产生白雾,白雾是水解生成HCl与空气中水蒸气结合所致,则-SO2-基团结合2个-OH生成H2SO4,反应方程式为:SO2Cl2+2H2O=H2SO4+2HCl,W溶液中得到白色沉淀,是SO2Cl2水解生成H2SO4与BaCl2溶液反应生成的BaSO4,其物质的量为$\frac{X}{233}$mol,根据S元素守恒,参加反应的二氧化硫物质的量为$\frac{X}{233}$mol,烧杯中白色沉淀是未反应的二氧化硫转化为硫酸钠,硫酸钠与BaCl2溶液反应生成的BaSO4,其物质的量为$\frac{Y}{233}$mol,故通入的二氧化硫总物质的量($\frac{X}{233}$+$\frac{Y}{233}$)mol,则SO2的转化率为$\frac{\frac{X}{233}}{\frac{X}{233}+\frac{Y}{233}}$×100%=$\frac{x}{x+y}$×100%,
故答案为:SO2Cl2+2H2O=H2SO4+2HCl,$\frac{x}{x+y}$×100%.
点评 本题考查制备实验方案,涉及化学方程式书写、对装置与操作的分析评价、离子检验、化学计算等,明确原理是解题关键,需要学生具备扎实的基础,难度中等.

| A. | pH均为12的烧碱溶液与Ba(OH)2溶液的物质的量浓度之比 | |
| B. | (NH4)2SO4溶液中c(NH4+)与c(SO42-)之比 | |
| C. | 0.2mol/L的CH3COOH溶液与0.1mol/L和CH3COOH溶液中c(H+)之比 | |
| D. | 0.2mol/L的HCl与0.1mol/LHNO3溶液中n(H+)之比 |
| A. | PCl3的水解产物是PH3和HCl | B. | CuCl2的水解产物是Cu(OH)2和HCl | ||
| C. | NaClO的水解产物是HClO和NaOH | D. | CaO2的水解产物是Ca(OH)2和H2O2 |
| A. | 氯化氢与氢氧化钠反应的中和热△H=-57.3kJ/mol,则硫酸和氢氧化钡反应的△H=-2×(-57.3)kJ/mol | |
| B. | CO(g)的燃烧热是283.0KJ/mol,则表示一氧化碳的燃烧热的热化学方程式为CO(g)+1/2O2(g)=CO2(g)△H=-283.0kJ/mol | |
| C. | 需要加热的反应一定是吸热反应,常温下能发生的反应一定是放热反应 | |
| D. | 已知: Ⅰ:对于反应:H2(g)+Cl2(g)=2HCl(g)△H=-a kJ/mol Ⅱ:  且a、b、c均大于零,则断开1摩尔H-Cl键所需的能量为(-a-b-c) kJ/mol 且a、b、c均大于零,则断开1摩尔H-Cl键所需的能量为(-a-b-c) kJ/mol |
| A. | NH4+、Al3+、SO42-、NO3- | B. | K+、Na+、NO3-、AlO2- | ||
| C. | K+、MnO4-、NH4+、NO3- | D. | Fe2+、K+、SO42-、NO3- |
 A、B、C、X均为中学化学常见物质,一定条件下它们有如下转化关系(其它产物已略去),下列说法正确的是( )
A、B、C、X均为中学化学常见物质,一定条件下它们有如下转化关系(其它产物已略去),下列说法正确的是( )| A. | 若X为KOH溶液,则A可能为Al | |
| B. | 若A、B、C均为焰色反应呈黄色的化合物,则X一定为CO2 | |
| C. | 若X为O2,则A可为非金属单质硫 | |
| D. | 若X为Fe,则C可能为Fe(NO3)2溶液 |
| A. | NaHCO3═Na++H++CO32- | B. | NaHSO4═Na++HSO4- | ||
| C. | Al2 (SO4)3═Al 3++SO42- | D. | Na2SO4═2Na++SO42 |
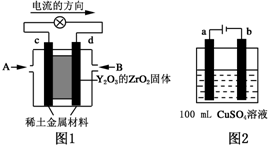 (1)科学家制造出一种使用固体电解质的燃料电池,其效率更高,可用于航空航天.如图1所示装置中,以稀土金属材料为惰性电极,在两极上分别通入CH4和空气,其中固体电解质是掺杂了Y2O3的ZrO2固体,它在高温下能传导阳极生成的O2-(O2+4e--→2O2-).
(1)科学家制造出一种使用固体电解质的燃料电池,其效率更高,可用于航空航天.如图1所示装置中,以稀土金属材料为惰性电极,在两极上分别通入CH4和空气,其中固体电解质是掺杂了Y2O3的ZrO2固体,它在高温下能传导阳极生成的O2-(O2+4e--→2O2-).