题目内容
3.现有一种黄铜矿和硫磺为原料制取铜和其他产物的新工艺,原料的综合利用率较高.其主要流程如下: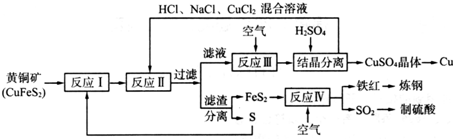
注:反应Ⅱ的离子方程式为Cu2++CuS+4Cl-═2[CuCl2]-+S.
请回答下列问题:
(1)从黄铜矿冶炼粗铜的传统工艺是将精选后的富铜矿砂与空气在高温下煅烧,使其转变为铜.这种方法的缺点是SO2会导致大气污染,同时要消耗大量的热能.
(2)反应I的产物为FeS2、CuS(填化学式).
(3)反应Ⅲ的离子方程式为4CuCl2-+O2+4H+═4Cu2++8Cl-+2H2O.
(4)一定温度下,在反应Ⅲ所得的溶液中加入稀硫酸,可以析出硫酸铜晶体,其原因是该温度下,硫酸铜的溶解度小于氯化铜.
(5)黄铜矿中Fe的化合价为+2,关于反应:8CuFeS2+21O2$\frac{\underline{\;高温\;}}{\;}$ 8Cu+4FeO+2Fe2O3+16SO2,下列说法中正确的是BCD.
A.反应中被还原的元素只有氧
B.反应生成的SO2直接排放会污染环境
C.SO2既是氧化产物又是还原产物
D.当有8mol铜生成时,转移电子数目为100NA
(6)某硫酸厂为测定反应Ⅳ所得气体中SO2的体积分数,取280mL(标准状况)气体样品与足量Fe2(SO4)3溶液完全反应后,用浓度为0.020 00mol/L.K2Cr2O7标准溶液滴定至终点,消耗K2Cr2O7溶液25.00mL.
已知:Cr2O72-+Fe2++H+→Cr3++Fe3++H2O(未配平).
①SO2通入Fe2(SO4)3溶液,发生反应的离子方程式为SO2+2Fe3++2H2O=SO42-+2Fe2++4H+;
②反应Ⅳ所得气体中SO2的体积分数为12.00%.
分析 (1)富铜矿砂与空气在高温下煅烧,使其转变为铜,反应产物有污染性气体二氧化硫生成;
(2)由流程可知,黄铁矿分解生成的Fe、Cu均为+2价;
(3)反应Ⅲ中生成铜离子;
(4)考虑产物的溶解度,溶解度小的先从溶液中析出;
(5)分析化合价变化,根据化合价的变化来判断和计算;
(6)①发生氧化还原反应生成硫酸亚铁;
②利用14H++Cr2O72-+6Fe2+═2Cr3++6Fe3++7H2O、SO2+2Fe3++2H2O=SO42-+2Fe2++4H+,可知,3SO2~Cr2O72-,以此计算.
解答 解:(1)富铜矿砂与空气在高温下煅烧,要消耗大量的热能,生成SO2会导致大气污染,故答案为:SO2会导致大气污染,同时要消耗大量的热能;
(2)由流程可知,黄铁矿分解生成的Fe、Cu均为+2价,则反应I的产物为FeS2、CuS,故答案为:FeS2、CuS;
(3)反应Ⅲ中生成铜离子,则离子反应为4CuCl2-+O2+4H+═4Cu2++8Cl-+2H2O,故答案为:4CuCl2-+O2+4H+═4Cu2++8Cl-+2H2O;
(4)相同条件下硫酸铜的溶解度小,则该温度下,硫酸铜的溶解度小于氯化铜,所以向反应Ⅲ所得的溶液中加入稀硫酸,可以析出硫酸铜晶体,
故答案为:该温度下,硫酸铜的溶解度小于氯化铜;
(5)A.反应中被还原的除了O元素还有Cu元素,故A错误;B.二氧化硫为大气污染物,故B正确;C.从S元素化合价变化看,二氧化硫为氧化产物,从O元素化合价变化看,二氧化硫为还原产物,故C正确;D.8CuFeS2反应转移电子为8×2+21×4=100,故D正确,故选B、C、D;
(6)①发生氧化还原反应生成硫酸亚铁,离子反应为SO2+2Fe3++2H2O=SO42-+2Fe2++4H+,故答案为:SO2+2Fe3++2H2O=SO42-+2Fe2++4H+;
②利用14H++Cr2O72-+6Fe2+═2Cr3++6Fe3++7H2O、SO2+2Fe3++2H2O=SO42-+2Fe2++4H+,
可知,3SO2~Cr2O72-,
3 1
x 0.02mol/L×0.025L
解得x=0.0015mol,
反应Ⅳ所得气体中SO2的体积分数为:$\frac{0.0015mol}{0.28L/22.4L/mol}$×100%=12.00%,
故答案为:12.00%.
点评 本题以实际化工生产“黄铜矿的综合利用”为背景,考查了元素化合物知识,离子方程式和化学方程式的书写及有关计算,题目更注重考查学生利用化学原理来解决实际问题的能力,利用关系式计算可简化计算.

 能考试期末冲刺卷系列答案
能考试期末冲刺卷系列答案| A. | 推广“低碳经济”,减少温室气体的排放 | |
| B. | 开发太阳能、风能和氢能等能源代替化石燃料,有利于节约资源、保护环境 | |
| C. | 采用“绿色化学”工艺,使原料尽可能转化为所需要的物质 | |
| D. | 关停化工企业,消除污染源头 |
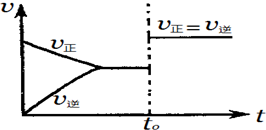
| A. | 若a+b=c,则t0时可能是增大反应体系的压强 | |
| B. | 若a+b=c,则t0时不可能是加入催化剂 | |
| C. | 若a+b≠c,则t0时只可能是加入催化剂 | |
| D. | 若a+b≠c,则t0时有可能是增大反应体系的压强 |
| A. | pH均为12的烧碱溶液与Ba(OH)2溶液的物质的量浓度之比 | |
| B. | (NH4)2SO4溶液中c(NH4+)与c(SO42-)之比 | |
| C. | 0.2mol/L的CH3COOH溶液与0.1mol/L和CH3COOH溶液中c(H+)之比 | |
| D. | 0.2mol/L的HCl与0.1mol/LHNO3溶液中n(H+)之比 |
| A. | 此白色固体不可能是KHCO3和KOH的混合物 | |
| B. | 此白色固体中含有K2CO36.90g | |
| C. | 原KOH溶液的物质的量浓度是0.500 mol•L-1 | |
| D. | 此白色固体可能为KOH和K2CO3的混合物 |
| A. | PCl3的水解产物是PH3和HCl | B. | CuCl2的水解产物是Cu(OH)2和HCl | ||
| C. | NaClO的水解产物是HClO和NaOH | D. | CaO2的水解产物是Ca(OH)2和H2O2 |

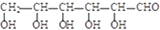 碱性条件下氧化为
碱性条件下氧化为 .
.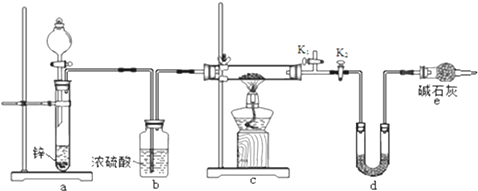
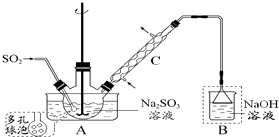 次硫酸氢钠甲醛(NaHSO2•HCHO•2H2O) 俗称吊块,在印染、医药以及原子能工业中应用广泛.实验室以Na2SO3、SO2、HCHO和锌粉为原料,通过以下反应制得:
次硫酸氢钠甲醛(NaHSO2•HCHO•2H2O) 俗称吊块,在印染、医药以及原子能工业中应用广泛.实验室以Na2SO3、SO2、HCHO和锌粉为原料,通过以下反应制得: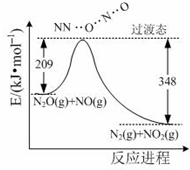 氨是合成硝酸、铵盐和氮肥的基本原料,回答下列问题:
氨是合成硝酸、铵盐和氮肥的基本原料,回答下列问题: