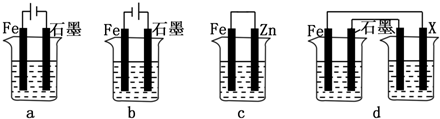
题目内容
6.下列离子方程式正确的是( )| A. | 铁粉撒入稀硫酸中2Fe+6H+→2Fe3++3H2↑ | |
| B. | 向AlCl3溶液中加入过量的氨水:Al3++4NH3•H2O→AlO2-+4NH4++2H2O | |
| C. | 把金属钠放入冷水中:Na+H2O→Na++OH-+H2↑ | |
| D. | 用氢氧化钠溶液除去铝表面的氧化铝:Al2O3+2OH-→2AlO2-+H2O |
分析 A.铁与稀硫酸反应生成的是硫酸亚铁,不会生成铁离子;
B.氨水为弱碱,氯化铝与氨水反应生成氢氧化铝沉淀;
C.钠与水反应生成氢氧化钠和氢气,该反应不满足电子守恒;
D.氧化铝为两性氧化物,能够与氢氧化钠溶液反应生成偏铝酸钠和水.
解答 解:A.铁粉撒入稀硫酸中,反应生成硫酸亚铁和氢气,正确的离子方程式为:Fe+2H+=Fe2++H2↑,故A错误;
B.氨水为弱碱,氯化铝与氨水反应生成氯化铵和氢氧化铝,正确的离子方程式为:Al3++3NH3•H2O=Al(OH)3↓+3NH4+,故B错误;
C.把金属钠放入冷水中,反应生成氢氧化钠和氢气,正确的离子方程式为:2Na+2H2O=2Na++2OH-+H2↑,故C错误;
D.用氢氧化钠溶液除去铝表面的氧化铝,反应的离子方程式为:Al2O3+2OH-=2AlO2-+H2O,故D正确;
故选D.
点评 本题考查了离子方程式的书写判断,为高考的高频题,属于中等难度的试题,注意明确离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合守恒关系(如:质量守恒和电荷守恒等)等.

练习册系列答案
相关题目
5.化学与材料、生活和环境密切相关.下列有关说法中错误的是( )
| A. | 煤炭经过干馏,石油经分馏、裂化、裂解化工处理,可获得清洁能源和重要的化工原料 | |
| B. | 比能量低而笨重的铅蓄电池使用时电压不稳定,所以有被其他新型电池取代的趋势 | |
| C. | 玛瑙饰品的主要成分与建筑材料砂子相同 | |
| D. | 神舟10号飞船所用太阳能电池板可将光能转换为电能,所用转换材料单晶硅也可以制备电脑芯片 |
6.下列说法正确的是( )
| A. | 金属元素在不同的化合物中化合价均相同 | |
| B. | 所有合金都只含有金属元素 | |
| C. | 可利用铝热反应冶炼单质镁 | |
| D. | 镁合金的硬度和强度均高于纯镁 |
14.“美丽中国”是十八大提出的重大课题,她突出了生态文明,重点是社会发展与自然环境之间的和谐,下列行为中不符合这一主题的是( )
| A. | 推广“低碳经济”,减少温室气体的排放 | |
| B. | 开发太阳能、风能和氢能等能源代替化石燃料,有利于节约资源、保护环境 | |
| C. | 采用“绿色化学”工艺,使原料尽可能转化为所需要的物质 | |
| D. | 关停化工企业,消除污染源头 |
1.下列说法正确的是( )
| A. | 体系有自发地向混乱度增加(即熵增)的方向转变的倾向,这是自然界的普遍规律 | |
| B. | 判断过程的自发性能确定过程能否发生和过程发生的速率 | |
| C. | 其它条件相同时,增大反应物浓度能使分子获得能量,活化分子百分数提高,反应速率增大 | |
| D. | 催化剂不影响反应活化能,从而只影响反应速率,不影响化学平衡 |
15.下列各组物质中比值为2:1的是( )
| A. | pH均为12的烧碱溶液与Ba(OH)2溶液的物质的量浓度之比 | |
| B. | (NH4)2SO4溶液中c(NH4+)与c(SO42-)之比 | |
| C. | 0.2mol/L的CH3COOH溶液与0.1mol/L和CH3COOH溶液中c(H+)之比 | |
| D. | 0.2mol/L的HCl与0.1mol/LHNO3溶液中n(H+)之比 |
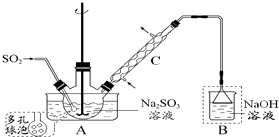 次硫酸氢钠甲醛(NaHSO2•HCHO•2H2O) 俗称吊块,在印染、医药以及原子能工业中应用广泛.实验室以Na2SO3、SO2、HCHO和锌粉为原料,通过以下反应制得:
次硫酸氢钠甲醛(NaHSO2•HCHO•2H2O) 俗称吊块,在印染、医药以及原子能工业中应用广泛.实验室以Na2SO3、SO2、HCHO和锌粉为原料,通过以下反应制得: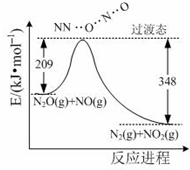 氨是合成硝酸、铵盐和氮肥的基本原料,回答下列问题:
氨是合成硝酸、铵盐和氮肥的基本原料,回答下列问题: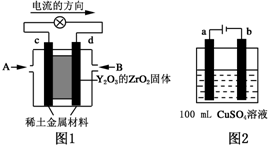 (1)科学家制造出一种使用固体电解质的燃料电池,其效率更高,可用于航空航天.如图1所示装置中,以稀土金属材料为惰性电极,在两极上分别通入CH4和空气,其中固体电解质是掺杂了Y2O3的ZrO2固体,它在高温下能传导阳极生成的O2-(O2+4e--→2O2-).
(1)科学家制造出一种使用固体电解质的燃料电池,其效率更高,可用于航空航天.如图1所示装置中,以稀土金属材料为惰性电极,在两极上分别通入CH4和空气,其中固体电解质是掺杂了Y2O3的ZrO2固体,它在高温下能传导阳极生成的O2-(O2+4e--→2O2-).