题目内容
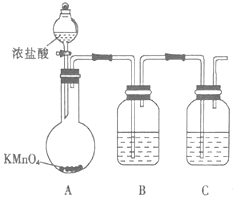
12.下列实验中,对应的现象以及结论都正确的是( )| 选项 | 实验 | 现象 | 结论 |
| A | 向酸性KMnO4溶液中滴加H2O2溶液至过量 | 紫色消失 | H2O2在该反应中作还原剂 |
| B | 溶有SO2的BaCl2溶液中通入气体X | 有白色沉淀生成 | X一定是Cl2 |
| C | 向FeBr2和KSCN混合溶液中滴入少量新制氯水,再加入CCl4混合振荡、静置 | 有机相呈红棕色,水相呈无色 | Fe2+的还原性大于Br- |
| D | 铝丝用砂纸打磨后,放在冷的浓硝酸中浸泡一段时间后,放入CuSO4溶液中 | 铝丝表面变红色 | 铝可从铜盐溶液中置换出铜 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.紫色消失,说明二者发生氧化还原反应,则双氧水被氧化,表现了还原性;
B.只能证明气体X具有强氧化性,能够氧化二氧化硫,该气体不一定为氯气;
C.氯气少量,亚铁离子优先反应,则有机层应该为无色;
D.Al表面被硝酸氧化钝化,形成致密的氧化膜,阻止了铝与硫酸铜溶液的反应.
解答 解:A.向酸性KMnO4溶液中滴加H2O2溶液至过量,酸性高锰酸钾溶液具有强氧化性,溶液紫色消失,证明二者发生氧化还原反应,则H2O2在该反应中被氧化,作还原剂,故A正确;
B.溶有SO2的BaCl2溶液中通入气体X,有白色沉淀生成,说明气体X能够氧化二氧化硫,可能为臭氧,不一定是Cl2,故B错误;
C.向FeBr2和KSCN混合溶液中滴入少量新制氯水,Fe2+的还原性大于Br-,则亚铁离子优先被氧化,再加入CCl4混合振荡、静置后有机相呈无色,水相呈红棕色,故C错误;
D.铝丝用砂纸打磨后,放在冷的浓硝酸中浸泡一段时间后,Al表面被硝酸氧化钝化,形成致密的氧化膜,三氧化二铝不与硫酸铜反应,则铝表面不会生成铜,故D错误;
故选A.
点评 本题考查了化学实验方案的评价,题目难度中等,涉及氧化还原反应、未知物判断、铝的化学性质等知识,明确常见元素及其化合物性质为解答关键,试题培养了学生的分析能力及化学实验能力.

练习册系列答案
相关题目
3.工业上合成氨的反应是:N2(g)+3H2(g)?2NH3(g)△H=-92.20kJ•mol-1.
(1)在绝热固定容积的密闭容器发生反应:N2(g)+3H2(g)?2NH3(g),能说明上述反应向正反应方向移动的是②④
①单位时间内生成2n mol NH3的同时生成3n mol H2
②单位时间内生成6n mol N-H的同时生成2n mol H-H
③用N2、H2、NH3的物质的量浓度变化表示的反应速率之比为1:3:2
④混合气体的平均摩尔质量增大
⑤容器内气体密度不变
(2)已知合成氨反应在某温度下2L的密闭容器中进行,测得如下数据:
根据表中数据计算:
①反应进行到2小时时放出的热量为27.78KJ
②0~l小时内N2的平均反应速率0.05mol•L-1•h-1;
③此条件下该反应的化学平衡常数K=0.15(保留两位小数)
④反应达到平衡后,若往平衡体系中再加入N2、H2和NH3各1.00mol,化学平衡将向正反应方向移动(填“正反应”、“逆反应”或“不移动”).
(1)在绝热固定容积的密闭容器发生反应:N2(g)+3H2(g)?2NH3(g),能说明上述反应向正反应方向移动的是②④
①单位时间内生成2n mol NH3的同时生成3n mol H2
②单位时间内生成6n mol N-H的同时生成2n mol H-H
③用N2、H2、NH3的物质的量浓度变化表示的反应速率之比为1:3:2
④混合气体的平均摩尔质量增大
⑤容器内气体密度不变
(2)已知合成氨反应在某温度下2L的密闭容器中进行,测得如下数据:
| 时间(h) 物质的量(mol) | 0 | 1 | 2 | 3 | 4 |
| N2 | 1.50 | n1 | 1.20 | n3 | 1.00 |
| H2 | 4.50 | 4.20 | 3.60 | n4 | 3.00 |
| NH3 | 0 | 0.20 | 1.00 | 1.00 |
①反应进行到2小时时放出的热量为27.78KJ
②0~l小时内N2的平均反应速率0.05mol•L-1•h-1;
③此条件下该反应的化学平衡常数K=0.15(保留两位小数)
④反应达到平衡后,若往平衡体系中再加入N2、H2和NH3各1.00mol,化学平衡将向正反应方向移动(填“正反应”、“逆反应”或“不移动”).
20. 四种主族元素的性质或结构信息如下:
四种主族元素的性质或结构信息如下:
(1)M的原子结构示意图是 ;上述元素最高价氧化物对应的水化物碱性最强的是(写分子式)Mg(OH)2(元素用元素符号表示,下同!).
;上述元素最高价氧化物对应的水化物碱性最强的是(写分子式)Mg(OH)2(元素用元素符号表示,下同!).
(2)Y单质溶于热浓的硫酸产生的气体的化学式为SO2.
(3)能体现Z单质比Y单质活泼性强的一个化学方程式:S2-+Br2=S+2Br-.
(4)常温下,不能与X的单质持续发生反应的是(填选项序号)bce.
a.CuSO4溶液 b.Fe2O3 c.浓硫酸 d.NaOH溶液 e.Na2CO3固体
(5)铁元素与Z元素形成化合物FeZ3,FeZ3溶液按如图所示进行试验.装置通电后,连接电源正极(填“正极”或“负极”)碳棒边的煤油颜色将变深,另一碳棒附近溶液将出现的现象是溶液逐渐变成浅绿色.
 四种主族元素的性质或结构信息如下:
四种主族元素的性质或结构信息如下:| 元素编号 | 相关信息 |
| X | 地壳中含量最大的金属元素;元素最高价为+3价. |
| Y | 原子最外层电子数是电子层数的2倍,最外层电子数是X最外层电子数的2倍. |
| Z | 同周期主族元素中原子半径最小,常温下单质呈液态. |
| M | 能从海水中提取的金属元素,单质可在氮气或二氧化碳中燃烧. |
 ;上述元素最高价氧化物对应的水化物碱性最强的是(写分子式)Mg(OH)2(元素用元素符号表示,下同!).
;上述元素最高价氧化物对应的水化物碱性最强的是(写分子式)Mg(OH)2(元素用元素符号表示,下同!).(2)Y单质溶于热浓的硫酸产生的气体的化学式为SO2.
(3)能体现Z单质比Y单质活泼性强的一个化学方程式:S2-+Br2=S+2Br-.
(4)常温下,不能与X的单质持续发生反应的是(填选项序号)bce.
a.CuSO4溶液 b.Fe2O3 c.浓硫酸 d.NaOH溶液 e.Na2CO3固体
(5)铁元素与Z元素形成化合物FeZ3,FeZ3溶液按如图所示进行试验.装置通电后,连接电源正极(填“正极”或“负极”)碳棒边的煤油颜色将变深,另一碳棒附近溶液将出现的现象是溶液逐渐变成浅绿色.
7. 2016年8月10日《生物谷》载文称,“毒性气体”CO、NO及H2S可作为新型药物开发的潜在靶点,用以开发更多新型药物来帮助治疗多种人类疾病.下列有关这三种气体的说法正确的是( )
2016年8月10日《生物谷》载文称,“毒性气体”CO、NO及H2S可作为新型药物开发的潜在靶点,用以开发更多新型药物来帮助治疗多种人类疾病.下列有关这三种气体的说法正确的是( )
 2016年8月10日《生物谷》载文称,“毒性气体”CO、NO及H2S可作为新型药物开发的潜在靶点,用以开发更多新型药物来帮助治疗多种人类疾病.下列有关这三种气体的说法正确的是( )
2016年8月10日《生物谷》载文称,“毒性气体”CO、NO及H2S可作为新型药物开发的潜在靶点,用以开发更多新型药物来帮助治疗多种人类疾病.下列有关这三种气体的说法正确的是( )| A. | 都是电解质 | B. | 都易溶于水 | ||
| C. | 都能与碱溶液反应 | D. | 都属于共价化合物 |
4.下列说法正确的是( )
| A. | 在配制一定物质的量浓度溶液的实验中量筒是必需仪器 | |
| B. | 实验室中,盛装NaOH 溶液的试剂瓶用橡皮塞 | |
| C. | 某未知液中加入稀NaOH溶液,没有产生使湿润的红色石蕊试纸变蓝的气体,则该未知液中不含NH4+ | |
| D. | 用pH试纸测定某溶液的pH时,需预先用蒸馏水湿润pH 试纸 |
10.运用化学反应原理研究氮、硫单质及其化合物的性质是一个重要的课题.回答下列问题:
(1)恒容密闭窗口中,工业固氮反应N2(g)+3H2(g)?2NH3(g)的化学平衡常数K和温度的关系如表所示:
①从上表演列出数据分析,该反应为放热(填“吸热”或“放热”)反应
②有关工业合成氨的研究成果,曾于1918年、1931年、2007年三次荣膺诺贝尔化学奖.
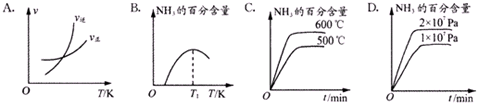
下列关于合成氨反应描述的图象中,不正确的是C(填序号).
③400℃时,测得某时刻氨气、氮气、氢气物质的量浓度分别为3mol•L-1、2mol•L-1、1mol•L-1,则该反应的v正<v逆(填“>”、“<”或“=”)
(2)近年来,科学家又提出在常温、常压、催化剂等条件下合成氨的新思路,反应原理为:2N2(g)+6H2O(g)?4NH3(g)+3O2(g),则其反应热△H=+1530kJ•mol-1.[已知:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ•mol-1,2H2(g)+O2(g)?2H2O(1)△H=-571.6kJ•mol-1]
(3)联氨(N2H4)、二氧化氮(NO2)可与KOH溶液构成碱性燃料电池,其电池反应原理为2N2H4+2NO2═3N2+4H2O,则负极的电极反应式为N2H4-4e-+4OH-=N2+4H2O.
(4)25℃时,将pH=3的盐酸和pH=11的氨水等体积混合后,溶液中的离子浓度由大到小的顺序为c(NH4+)>c(Cl-)>c(OH-)>c(H+).
(5)若将等物质的量的SO2与NH3溶于水充分反应,所得溶液中c(H+)-c(OH-)=c(HSO3-)+2c(SO32-)-c(NH4+)(填表达式).(已知:H2SO3的Ka1=1.7×10-2mol•L-1,Ka2=6.0×10-8mol•L-1;NH3•H2O的Kb=1.8×10-5mol•L-1)
(1)恒容密闭窗口中,工业固氮反应N2(g)+3H2(g)?2NH3(g)的化学平衡常数K和温度的关系如表所示:
| 温度/℃ | 25 | 200 | 300 | 400 | 500 |
| K | 5×108 | 1.0 | 0.86 | 0.507 | 0.152 |
②有关工业合成氨的研究成果,曾于1918年、1931年、2007年三次荣膺诺贝尔化学奖.
下列关于合成氨反应描述的图象中,不正确的是C(填序号).

③400℃时,测得某时刻氨气、氮气、氢气物质的量浓度分别为3mol•L-1、2mol•L-1、1mol•L-1,则该反应的v正<v逆(填“>”、“<”或“=”)
(2)近年来,科学家又提出在常温、常压、催化剂等条件下合成氨的新思路,反应原理为:2N2(g)+6H2O(g)?4NH3(g)+3O2(g),则其反应热△H=+1530kJ•mol-1.[已知:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ•mol-1,2H2(g)+O2(g)?2H2O(1)△H=-571.6kJ•mol-1]
(3)联氨(N2H4)、二氧化氮(NO2)可与KOH溶液构成碱性燃料电池,其电池反应原理为2N2H4+2NO2═3N2+4H2O,则负极的电极反应式为N2H4-4e-+4OH-=N2+4H2O.
(4)25℃时,将pH=3的盐酸和pH=11的氨水等体积混合后,溶液中的离子浓度由大到小的顺序为c(NH4+)>c(Cl-)>c(OH-)>c(H+).
(5)若将等物质的量的SO2与NH3溶于水充分反应,所得溶液中c(H+)-c(OH-)=c(HSO3-)+2c(SO32-)-c(NH4+)(填表达式).(已知:H2SO3的Ka1=1.7×10-2mol•L-1,Ka2=6.0×10-8mol•L-1;NH3•H2O的Kb=1.8×10-5mol•L-1)
11.设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 常温常压下,20gH218O中含有中子数目为12NA | |
| B. | 标准状况下,11.2LC2H6中含有极性键的数目为3.5NA | |
| C. | 1LpH=3的CH3COOH溶液中,含有H+的数目大于10-3NA | |
| D. | 1L1mol•L-1稀硝酸(还原产物为NO)与铁完全反应,转移电子数目为0.75NA |
 酸碱中和在化工生产中有着重要应用.
酸碱中和在化工生产中有着重要应用.