题目内容
7.乙醇分子中不同化学键如图所示,关于乙醇在各种反应中断裂的键不正确的是( )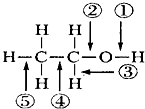
| A. | 在Cu催化作用下和O2反应时键①⑤断裂 | |
| B. | 和氢溴酸共热时键②断裂 | |
| C. | 和金属钠反应时键①断裂 | |
| D. | 和浓硫酸加热到170℃,键②⑤断裂 |
分析 A、乙醇在铜催化下和O2反应生成乙醛,结合反应机理判断;
B、与氢卤酸反应时,②键断裂;
C、乙醇与金属钠反应生成乙醇钠,脱去羟基上的氢原子;
D、醇与浓硫酸共热至170℃发生消去反应;
解答 解:A、乙醇在银催化下和O2反应生成乙醛,反应机理是断开-OH中的-H和-OH所在碳原子上的-H,即断开①③,故A错误;
B、与氢卤酸反应时,是用-Br取代了醇中的-OH,属于取代反应,②键断裂,故B正确;
C、乙醇与金属钠反应生成乙醇钠,脱去羟基上的氢原子,即键①断裂,故C正确;
D、醇与浓硫酸共热至170℃发生消去反应,脱去羟基和相邻碳原子上的氢,即键②⑤断裂,故D正确;
故选A.
点评 乙醇的性质是高考热点题型,每年必考.本题重点考查了乙醇发生化学反应式键的断裂情况.

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目
17.下列说法正确的是( )
| A. | 将亚硫酸钠溶液在空气中蒸干、灼烧,得到的物质的主要成分是亚硫酸钠 | |
| B. | 硝酸亚铁溶液中加入一定量的盐酸可抑制Fe2+的水解,提高Fe2+的浓度 | |
| C. | 室温下OH-浓度相同的醋酸钠和碳酸钠的溶液加水稀释相同的倍数后,碳酸钠溶液的碱性弱 | |
| D. | 25℃,HCN的电离平衡常数Ka=5.0×10-10,同浓度的HCN和NaCN的混合溶液呈酸性 |
15.下列试剂不能用于区分SO2和CO2的是( )
| A. | 澄清石灰水 | B. | 酸性高锰酸钾溶液- | ||
| C. | 溴水 | D. | 硝酸钡溶液 |
2.在浓盐酸中H3AsO3与SnCl2反应的离子方程式为3SnCl2+12Cl-+2H3AsO3+6H+═2As+3SnCl62-+6M,关于该反应的说法中不正确的是( )
| A. | M为H2O | |
| B. | SnCl62-是氧化产物 | |
| C. | 还原性:As>SnCl2 | |
| D. | 每生成1molAs,反应中转移电子的物质的量为3mol |
19.下列反应的离子方程式书写正确的是( )
| A. | 钠与水反应:Na+2H2O═Na++2OH-+H2↑ | |
| B. | 向Al2(SO4)3溶液中加入过量NH3?H2O:Al3++4NH3?H2O═AlO2-+4NH4++2H2O | |
| C. | 酸性溶液中KClO3与KCl反应生成Cl2:ClO3-+Cl-+6H+═Cl2↑+3H2O | |
| D. | 向含1molNaHSO3的溶液中加入1molNa2O2:Na2O2+HSO3-═2Na++SO42-+OH- |
16.如图是某同学设计的验证原电池和电解池的实验装置,下列说法不正确的是( )
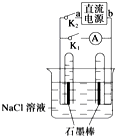

| A. | 若关闭K2、打开K1,一段时间后,发现左侧试管收集到的气体比右侧略多,则a为正极,b为负极 | |
| B. | 关闭K2,打开K1,一段时间后,用拇指堵住试管移出烧 杯,向试管内滴入酚酞,发现左侧试管内溶液变红色,则 a为负极,b为正极 | |
| C. | 若直流电源a为负极,b为正极,关闭K2,打开K1,一段时间后,再关闭K1,打开K2,则电路中电流方向为从右侧石墨棒沿导线到左侧石墨棒 | |
| D. | 若直流电源a为负极,b为正极,关闭K2,打开K1,一段时间后,再关闭K1,打开K2,则左侧石墨棒上发生的电极反应为H2-2e-+2OH-═2H2O |
17.用吸附了氢气的纳米碳管等材料制作的二次电池的原理如图所示,下列说法正确的是( )大.

| A. | 放电时,正极质量增加 | |
| B. | 充电时,溶液中OH-移向碳电极 | |
| C. | 充电时,将电池的碳电极与外电源的负极相连 | |
| D. | 放电时,电路中每转移2mol电子,碳电极上有1molH2被还原 |
 如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.
如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.