题目内容
18. 如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.
如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.Ⅰ.硫酸具有A~D所示的性质,以下过程主要表现了浓硫酸的那些性质.
A.酸性 B.吸水性 C.脱水性 D.强氧化性
(1)浓硫酸可以干燥氢气B;
(2)浓硫酸使木条变黑C;
(3)热的浓硫酸与铜片反应AD.(填序号)
Ⅱ.现用该浓硫酸配制100mL1.000mol/L的稀硫酸.可供选用的仪器有:①胶头滴管;②烧瓶;③烧杯;④药匙;⑤量筒;⑥托盘天平;⑦玻璃棒;⑧100mL容量瓶.请回答:
(1)配制稀硫酸时,上述仪器中需要使用的除①③⑤外,还有⑦⑧(填序号).
(2)经计算,配制100mL1.000mol/L的稀硫酸需要用量筒量取上述浓硫酸的体积为5.4mL.
(3)下列操作会使配制的溶液浓度偏高的是B.
A.量取浓H2SO4时,俯视刻度线
B.定容时,俯视容量瓶刻度线
C.配置前,容量瓶中有水珠
D.定容后摇匀发现液面下降,但未向其中再加水.
分析 Ⅰ、(1)依据浓硫酸具有吸水性分析判断;
(2)依据浓硫酸具有脱水性分析;
(3)浓硫酸和铜反应生成硫酸铜、二氧化硫和水,依据浓硫酸的强氧化性和酸性分析;
Ⅱ.(1)根据实验步骤确定操作所需仪器;
(2)浓硫酸的物质的量浓度为c=$\frac{1000ρω}{M}$=$\frac{1000×1.84×98%}{98}$=18.4mol/L,结合溶液稀释前后溶质的物质的量不变计算;
(3)根据c=$\frac{n}{V}$结合操作的方法判断误差.
解答 解:Ⅰ、(1)浓硫酸可以干燥氢气,利用的是浓硫酸具有吸水性做干燥剂;
故答案为:B;
(2)浓硫酸使木条变黑是利用浓硫酸具有脱水性;
故答案为:C;
(3)热的浓硫酸与铜片反应生成硫酸铜、二氧化硫和水,表现了浓硫酸的酸性和强氧化性;
故答案为:AD;
Ⅱ.(1)配制100mL 1mol/L的稀硫酸,可用量筒量取一定体积的浓硫酸,在烧杯中加水稀释,冷却后转移到100mL容量瓶中,并用玻璃棒引流,并洗涤烧杯,将洗涤液一并转移到容量瓶中,加入蒸馏水至刻度线2~3cm时,改用教头滴管定容,则还需要的仪器有玻璃棒和100mL容量瓶,
故答案为:⑦⑧;
(2)浓硫酸的物质的量浓度为c=$\frac{1000ρω}{M}$=$\frac{1000×1.84×98%}{98}$=18.4mol/L,设需浓硫酸的体积为V,则有V×18.4mol/L=0.1L×1mol/L,
V=0.0054L=5.4mL,
故答案为:5.4;
(3)A.量取浓H2SO4时,俯视刻度线,会导致量取液体体积偏小,浓度偏低,故A错误;
B.定容时,俯视容量瓶刻度线,会导致体积偏小,浓度偏大,故B正确
C.配制前,容量瓶中有水珠,对实验没有影响,故C错误;
D.定容后摇匀发现液面下降而未向其中再加水,浓度没有影响,故D错误.
故答案为:B.
点评 本题考查较为综合,涉及浓硫酸的性质以及溶液的配制,侧重于学生的分析能力和实验能力的考查,难度不大,注意相关基础知识的积累.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 加入适量铜粉除去Cu(NO3)2溶液中的Fe(NO3)3杂质 | |
| B. | 在物质提纯操作中不能用乙醇从碘水中萃取碘 | |
| C. | 向Ca(ClO)2溶液中通入CO2,溶液变浑浊,再加入品红溶液,红色褪去 | |
| D. | 向Ca(OH)2溶液中通入CO2,溶液变浑浊,继续通CO2至过量,浑浊消失 |
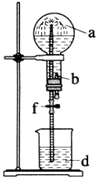 在如图装置中,烧瓶中充满干燥气体a,将滴管中的液体b挤入烧瓶内,轻轻振荡烧瓶,然后打开弹簧夹f,烧杯中的液体b呈喷泉状喷出,最终几乎充满烧瓶.a和b分别是( )
在如图装置中,烧瓶中充满干燥气体a,将滴管中的液体b挤入烧瓶内,轻轻振荡烧瓶,然后打开弹簧夹f,烧杯中的液体b呈喷泉状喷出,最终几乎充满烧瓶.a和b分别是( )| a(干燥气体) | b(液体) | |
| A | NO2 | 水 |
| B | CO2 | 水 |
| C | Cl2 | 饱和食盐水 |
| D | NH3 | 水 |
| A. | A | B. | B | C. | C | D. | D |
| A. | Cu2+和Fe2+ | B. | H+和Cu2+ | C. | Fe2+和Mg2+ | D. | Fe3+和Fe2+ |
| A. | 1molCO2的质量为44g/mol | |
| B. | H2SO4的摩尔质量为98 | |
| C. | 标准状况下,气体摩尔体积约为22.4L | |
| D. | O2的相对分子质量为32 |
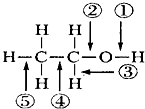
| A. | 在Cu催化作用下和O2反应时键①⑤断裂 | |
| B. | 和氢溴酸共热时键②断裂 | |
| C. | 和金属钠反应时键①断裂 | |
| D. | 和浓硫酸加热到170℃,键②⑤断裂 |
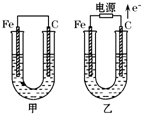 甲、乙两池电极材料都是铁棒与碳棒,两池中均为饱和NaCl溶液,请回答下列问题:
甲、乙两池电极材料都是铁棒与碳棒,两池中均为饱和NaCl溶液,请回答下列问题:

 .
. .
. .
.