题目内容
12.5.8g某有机物Q完全燃烧可产生13.2g CO2和0.3molH2O.已知Q蒸气对氢气的相对密度是29;Q能发生酯化反应,分子中不含甲基,为链状结构.请通过计算确定Q的稳定结构的结构简式(烯醇式:C=C-OH不稳定).分析 Q蒸气对氢气的相对密度是29,则Mr(Q)=29×2=58,计算Q与二氧化碳的物质的量,再根据原子守恒计算分子中C、H原子数目,结合相对分子质量计算氧原子数目,可以确定Q的分子式,Q能够发生酯化反应,至少含有-OH、-COOH中的一种,且Q分子中不含甲基,为链状结构,结合分子式确定Q的结构简式.
解答 解:Q蒸气对氢气的相对密度是29,则Mr(Q)=29×2=58,
5.8gQ的物质的量是:$\frac{5.8g}{58g/mol}$=0.1mol,
13.2g二氧化碳的物质的量为:$\frac{13.2g}{44g/mol}$=0.3mol,0.3molCO2中n(C)=0.3mol,
0.3molH2O中n(H)=0.6mol,
所以Q分子中N(C)=$\frac{0.3mol}{0.1mol}$=3、N(H)=$\frac{0.6mol}{0.1mol}$=6,分子中N(O)=$\frac{58-12×3-1×6}{16}$=1,
则Q的分子式为:C3H6O,
Q分子中不含甲基,且为链状结构、能够发生酯化反应,则Q分子中含有碳碳双键和羟基,结合C=C-OH不稳定,可知Q的结构简式为:CH2=CH-CH2-OH,
答:Q的结构简式为CH2=CH-CH2-OH.
点评 本题考查了有机物分子式与结构简式的确定,题目难度中等,注意掌握质量守恒定律在确定有机物分子式的应用方法,试题侧重考查学生的分析、理解能力及化学计算能力.

练习册系列答案
 赢在课堂名师课时计划系列答案
赢在课堂名师课时计划系列答案 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案
相关题目
3.下列叙述正确的是( )
| A. | 1molCO2的质量为44g/mol | |
| B. | H2SO4的摩尔质量为98 | |
| C. | 标准状况下,气体摩尔体积约为22.4L | |
| D. | O2的相对分子质量为32 |
20.如表除杂方案正确的是( )
| 选项 | 被提纯的物质 | 杂质 | 除杂试剂 | 除杂方法 |
| A | CO(g) | CO2(g) | 饱和NaHCO3溶液、浓硫酸 | 洗气 |
| B | FeCl2(aq) | CuCl2 | 铁粉 | 过滤 |
| C | Cl2(g) | HCl(g) | NaOH溶液、浓硫酸 | 洗气 |
| D | NaHCO3(aq) | Na2CO3(aq) | 盐酸 | - |
| A. | A | B. | B | C. | C | D. | D |
7.乙醇分子中不同化学键如图所示,关于乙醇在各种反应中断裂的键不正确的是( )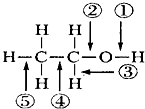

| A. | 在Cu催化作用下和O2反应时键①⑤断裂 | |
| B. | 和氢溴酸共热时键②断裂 | |
| C. | 和金属钠反应时键①断裂 | |
| D. | 和浓硫酸加热到170℃,键②⑤断裂 |
4.下列反应中一定属于吸热反应的是( )
| A. | 需加热或点燃才能引发的反应 | |
| B. | 氧化还原反应 | |
| C. | 氢氧化钡晶体和氯化铵晶体混合搅拌 | |
| D. | 一氧化碳和氧气反应 |
 依据氧化还原反应:2Ag+(aq)+Cu(s)═Cu2+(aq)+2Ag(s)设计的原电池如图所示.
依据氧化还原反应:2Ag+(aq)+Cu(s)═Cu2+(aq)+2Ag(s)设计的原电池如图所示.
 .
. .
.