题目内容
11.铁是当代社会中用量最大的金属之一.磁铁矿是工业上冶炼铁的原料之一,发生的主要反应为:Fe3O4(s)+4CO?3Fe(s)+4CO2(1)已知:①Fe3O4(s)+4C(石墨)?3Fe(s)+4CO(g)△H=+646.0kJ/mol
②C(石墨)+CO2(g)?2CO(g)△H=+172.5kJ/mol
由Fe3O4(s)与CO反应生成Fe(s)的热化学方程式是Fe3O4(s)+4CO(g)=3Fe(s)+4CO2(g)△H=-44.0kJ/mol.
(2)T℃时,在 2L恒容密闭容器中,加入Fe3O4、CO各1.0mol,10min反应达到平衡时,容器中CO2的浓度是0.4mol/L.
①能证明该反应达到化学平衡的是c(选填字母).
a.容器内压强不再变化 b.容器内CO、CO2物质的量比为1:1
c.容器内气体的质量不再变化 d.生成CO2的速率与消耗CO的速率相等
②CO的平衡转化率是80%.
③l0min内,反应的平均反应速率v (CO2)=0.04mol/(L.min).
④欲提高该反应中CO的平衡转化率,可采取的措施是b(选填字母).
a.提高反应温度 b.移出部分CO2
c.加入合适的催化剂 d.减小容器的容积
⑤T℃时,该反应的平衡常数K=256.
分析 (1)发生反应:Fe3O4+4CO=3Fe+4CO2,根据盖斯定律书写目标热化学方程式;
(2)①可逆反应到达平衡时,正、逆反应速率相等,各组分的浓度、含量不变,由此衍生的一些其它物理量不变,注意判断平衡的物理量应随反应进行发生变化,当该物理量由变化到不变化,说明到达平衡;
②利用三段式计算平衡时各组分浓度、各组分浓度变化量,进而计算CO的转化率;
③根据v=$\frac{△c}{△t}$计算v(CO2);
④欲提高该反应中CO的平衡转化率,应改变条件使平衡向正反应方向移动,结合平衡移动原理方向,注意反应前后气体的体积不变;
⑤结合②中的计算,代入平衡常数K=$\frac{{c}^{4}(C{O}_{2})}{{c}^{4}(CO)}$计算.
解答 解:(1)已知:①Fe3O4(s)+4C(石墨)?3Fe(s)+4CO(g)△H=+646.0kJ/mol
②C(石墨)+CO2(g)?2CO(g)△H=+172.5kJ/mol
根据盖斯定律,①-②×4可得Fe3O4(s)+4CO(g)=3Fe(s)+4CO2(g),故△H=+646.0kJ/mol-4×(+172.5kJ/mol)=-44.0kJ/mol,故反应热化学方程式为:Fe3O4(s)+4CO(g)=3Fe(s)+4CO2(g)△H=-44.0kJ/mol,
故答案为:Fe3O4(s)+4CO(g)=3Fe(s)+4CO2(g)△H=-44.0kJ/mol;
(2)对应可逆反应:Fe3O4(s)+4CO(g)?3Fe(s)+4CO2(g)△H=-44.0kJ/mol,
①a.反应前后气体的体积不变,容器内压强始终不变化,压强不变化不能说明到达平衡,故a错误;
b.容器内CO、CO2物质的量比与CO的转化率有关,平衡时不一定为1:1,故b错误;
c.气体有CO转化为二氧化碳,气体的质量增大,容器内气体的质量不再变化,说明反应到达平衡,故c正确;
d.生成CO2的速率与消耗CO的速率相等,均表示正反应速率,反应始终按速率之比为1:1进行,故d错误,
故答案为:c;
②T℃时,在 2L恒容密闭容器中,加入Fe3O4、CO各1.0mol,10min反应达到平衡时,容器中CO2的浓度是0.4mol/L,则:
Fe3O4(s)+4CO(g)?3Fe(s)+4CO2(g)
开始(mol/L):0.5 0
转化(mol/L):0.4 0.4
平衡(mol/L):0.1 0.4
故CO的转化率为$\frac{0.4mol/L}{0.5mol/L}$×100%=80%,
故答案为:80%;
③10min内v(CO2)=$\frac{0.4mol/L}{10min}$=0.04mol/(L.min),
故答案为:0.04mol/(L.min);
④欲提高该反应中CO的平衡转化率,应改变条件使平衡向正反应方向移动,
a.正反应为放热反应,提高反应温度,平衡向逆反应方向移动,CO的转化率降低,故a错误;
b.移出部分CO2,平衡向正反应方向移动,CO的转化率增大,故b正确;
c.加入合适的催化剂,同等程度增大正、逆反应速率,缩短到达平衡的时间,平衡不移动,CO的转化率不变,故c错误;
d.减小容器的容积,压强增大,由于反应气体气体的体积不变,平衡不一定,CO转化率不变,故d错误,
故答案为:b;
⑤由平衡时二氧化碳浓度为0.4mol/L,由②中的计算可知,平衡时CO浓度为0.1mol/L,故该稳定性平衡常数K=$\frac{{c}^{4}(C{O}_{2})}{{c}^{4}(CO)}$=$\frac{0.{4}^{4}}{0.{1}^{4}}$=256,
故答案为:256.
点评 本题比较综合,涉及热化学方程式书写、平衡状态判断、反应速率计算、平衡常数计算、化学平衡移动及计算等,注意平衡状态判断中选择判断平衡的物理量应随反应进行发生变化,该物理量由变化到不变化,说明到达平衡,(3)中平衡常数计算时注意:同一反应中化学计量数不同,平衡常数也发生变化,难度中等.

 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案| A. | 黄铜 | B. | 合金钢 | C. | 硬铝 | D. | 金箔 |
| A. | 2molSO2和1molO2在一定条件下充分反应后,混合物的分子数为2NA | |
| B. | 25℃时,1L,pH=1的稀硫酸溶液中含有的H+数目为0.1NA | |
| C. | 用惰性电极电解1L浓度均为0.2mol/L的Cu(NO3)2和AgNO3的混合溶液,当有0.2NA个电子转移时,理论上阴极析出6.4g金属 | |
| D. | 电解精炼铜(粗铜含铁、锌、银、金杂质),阴极析出1 mol Cu,阳极失去的电子数小于2NA |
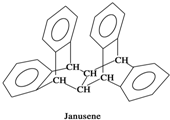 如图是一种形状酷似罗马两面神Janus的有机物结构简式,化学家建议将该分子叫做“Janusene”,下列说法正确的是( )
如图是一种形状酷似罗马两面神Janus的有机物结构简式,化学家建议将该分子叫做“Janusene”,下列说法正确的是( )| A. | Janusene的分子式为C30H20 | |
| B. | Janusene属于苯的同系物 | |
| C. | Janusene苯环上的一氯代物有8种 | |
| D. | Janusene既可发生氧化反应,又可发生还原反应 |
| A. | 6 | B. | 7 | C. | 9 | D. | 10 |
| A. | 蒸发操作时,应使混合物中的水分完全蒸干后,才能停止加热 | |
| B. | 蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处 | |
| C. | 萃取操作时,选择的萃取剂的密度必须比水大 | |
| D. | 分液操作时,上层液体从分液漏斗下口放出 |
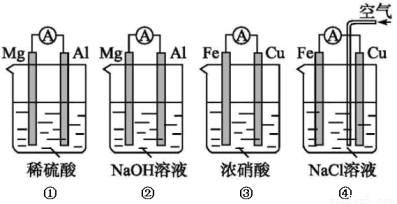
 -=H2↑
-=H2↑
 .
. .
. )是一种重要的有机合成中间体.试写出以苯、甲苯为原料制取该化合物的合成路线流程图(无机原料任选).合成路线流程图示例如下:
)是一种重要的有机合成中间体.试写出以苯、甲苯为原料制取该化合物的合成路线流程图(无机原料任选).合成路线流程图示例如下: .
.