题目内容
19.下列实验操作中正确的是( )| A. | 蒸发操作时,应使混合物中的水分完全蒸干后,才能停止加热 | |
| B. | 蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处 | |
| C. | 萃取操作时,选择的萃取剂的密度必须比水大 | |
| D. | 分液操作时,上层液体从分液漏斗下口放出 |
分析 A.在蒸发操作的过程中,当加热到有少量液体剩余时停止加热,此时剩下的少量液体可以利用余热蒸发干;
B.蒸馏操作温度计水银球靠近蒸馏烧瓶支管口处;
C.根据萃取剂的选择必须符合下列条件:溶质在萃取剂中的溶解度比在原溶剂中要大;萃取剂与原溶剂不相溶;萃取剂与溶质不反应;
D.下层液体从下口流出,上层液体从上口倒出.
解答 解:A.在蒸发操作的过程中,当加热到有少量液体剩余时停止加热,利用余热蒸发干,故A错误;
B.蒸馏操作时,温度计测的是要流出组分的温度,应使温度计水银球靠近蒸馏烧瓶支管口处,故B正确;
C.萃取剂的选择与密度无关,故C错误;
D.下层液体从下口流出,上层液体从上口倒出,防止污染液体,故D错误.
故选B.
点评 本题考查化学实验基本操作,题目难度不大,注意使用分液漏斗时下层液体从下口流出上层液体从上口倒出,防止污染液体.

练习册系列答案
 活力课时同步练习册系列答案
活力课时同步练习册系列答案
相关题目
10.氯酸是一种强酸,浓度超过40%时会发生分解,反应可表示为:a HClO3→b O2↑+c Cl2↑+d HClO4+e H2O,用湿润的淀粉碘化钾试纸检验气体产物时,试纸先变蓝后褪色.下列说法错误的是( )
| A. | 由反应可确定:氧化性HClO3>HClO4 | |
| B. | 变蓝的淀粉碘化钾试纸褪色是因为可能发生了:4C12+I2+6H2O→12H++8Cl-+2IO3- | |
| C. | 若氯酸分解所得的混合气体的平均摩尔质量为47.6g/mol,则反应方程式可表示为:26HClO3→15O2↑+8C12↑+10HClO4+8H2O | |
| D. | 若化学计量数a=8,b=3,则该反应转移电子数为20e |
7.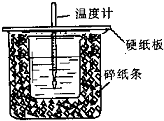 已知中和热的定义为:稀溶液中酸和碱发生中和反应生成1mol水的反应热,某化学兴趣小组要完成中和热的测定实验,装置如右图,回答下列问题:
已知中和热的定义为:稀溶液中酸和碱发生中和反应生成1mol水的反应热,某化学兴趣小组要完成中和热的测定实验,装置如右图,回答下列问题:
(1)从如图实验装置看,其中尚缺少的一种玻璃仪器的名称是
环形玻璃搅拌棒,碎纸条的作用是减少实验过程中的热量损失,如果大烧杯上不盖硬纸板,实验所测得的中和热会偏大(填“偏大”、“偏小”或“无影响”).
(2)实验数据记录如下表(t1为混合前两溶液平均温度,t2为混合充分反应后读取的温度):
①已知反应后溶液的比热容为4.18J•℃-1•g-1,各溶液密度均近似为1g•cm-3,计算完成上表(保留一位小数,将结果填写在表格中横线上)
②强酸与强碱反应的中和热理论值为-57.3kJ•mol-1,下面列举的情况中可能造成上述实验结果与理论值的差距的是ABC(填字母序号)
A.倒入反应溶液时有少许溅出
B.倒入NaOH溶液时速度缓慢
C.未在温度达到最高点时读数
③现用一定量的稀氢氧化钾溶液、澄清石灰水代替氢氧化钠溶液,分别与上述实验的盐酸恰好完全反应时的反应热分别为△H1、△H2,则理论上两者的大小关系为:△H1=△H2(填“<”“>”或“=”)
 已知中和热的定义为:稀溶液中酸和碱发生中和反应生成1mol水的反应热,某化学兴趣小组要完成中和热的测定实验,装置如右图,回答下列问题:
已知中和热的定义为:稀溶液中酸和碱发生中和反应生成1mol水的反应热,某化学兴趣小组要完成中和热的测定实验,装置如右图,回答下列问题:(1)从如图实验装置看,其中尚缺少的一种玻璃仪器的名称是
环形玻璃搅拌棒,碎纸条的作用是减少实验过程中的热量损失,如果大烧杯上不盖硬纸板,实验所测得的中和热会偏大(填“偏大”、“偏小”或“无影响”).
(2)实验数据记录如下表(t1为混合前两溶液平均温度,t2为混合充分反应后读取的温度):
| 实 验 用 品 | 溶液温度(℃) | 中和热△H(kJ•mol-1) | |||
| t1 | t2 | ||||
| ① | 50 mL 0.50 mol•L-1NaOH | 50 mL 0.50 mol•L-1HCl | 20 | 23.3 | -56.8 |
| ② | 50 mL 0.50 mol•L-1NaOH | 50 mL 0.50 mol•L-1HCl | 20 | 23.5 | |
②强酸与强碱反应的中和热理论值为-57.3kJ•mol-1,下面列举的情况中可能造成上述实验结果与理论值的差距的是ABC(填字母序号)
A.倒入反应溶液时有少许溅出
B.倒入NaOH溶液时速度缓慢
C.未在温度达到最高点时读数
③现用一定量的稀氢氧化钾溶液、澄清石灰水代替氢氧化钠溶液,分别与上述实验的盐酸恰好完全反应时的反应热分别为△H1、△H2,则理论上两者的大小关系为:△H1=△H2(填“<”“>”或“=”)
11.下列离子方程式正确的是( )
| A. | 用Al作电极电解NaHCO3溶液:2Al+6H2O═2Al(OH)3↓+3H2↑ | |
| B. | 向明矾溶液中加入氢氧化钡溶液至沉淀质量最大时:2Al3++2SO42-+2Ba2++6OH-═2BaSO4↓+2Al(OH)3↓ | |
| C. | 碳酸钠的水解反应:CO32-+H3O+═HCO3-+H2O | |
| D. | 酸性高锰酸钾溶液与双氧水反应:2MnO4-+5H2O2+6H+═2Mn2++5O2↑+8H2O |
7.已知:2H2(g)+O2(g)═2H2O(g)△H=-483.6kJ/mol.有关键能数据如下表:则水分子中O-H键能为( )
| 化学键 | H-H | O=O |
| 键能/kJ/mol | 436 | 498 |
| A. | 463.4kJ/mol | B. | 926.8kJ/mol | C. | 221.6kJ/mol | D. | 413kJ/mol |
 ;反应I除生成两种正盐外,还有水生成,其化学方程式为COS+4NaOH=Na2S+Na2CO3+2H2O;已知反应II的产物X的溶液中硫元素的主要存在形式为S2O32-,则II中主要反应的离子方程式为2S2-+5H2O=S2O32-+4H2↑+2OH-.
;反应I除生成两种正盐外,还有水生成,其化学方程式为COS+4NaOH=Na2S+Na2CO3+2H2O;已知反应II的产物X的溶液中硫元素的主要存在形式为S2O32-,则II中主要反应的离子方程式为2S2-+5H2O=S2O32-+4H2↑+2OH-.