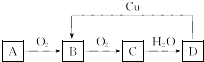
题目内容
3.一定温度下,在一定容的密闭容器中充入N2和H2发生如下反应:N2+3H2?2NH3,并达到平衡,此时N2的转化率为a%,缩小容器的体积,则N2的转化率将( )| A. | 增大 | B. | 减小 | C. | 不变 | D. | 无法确定 |
分析 该反应为气体体积减小的反应,一定温度下,缩小容器的体积,相当于增大压强,平衡向体积减小的方向移动,据此答题.
解答 解:该反应为气体体积减小的反应,一定温度下,缩小容器的体积,相当于增大压强,平衡向体积减小的方向移动,即反应向正反应方向移动,此时N2的转化率增大,故选A.
点评 本题考查了化学平衡的影响因素等知识点,难度不大,根据明确外界条件对平衡的影响是解本题关键.

练习册系列答案
 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案 品学双优卷系列答案
品学双优卷系列答案 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案
相关题目
将A和B加入密闭容器中,在一定条件下发生反应:A(g)+B(s) 2C(g),忽略固体体积,平衡时C的体积分数
2C(g),忽略固体体积,平衡时C的体积分数 (%)随温度和压强的变化如下表所示:
(%)随温度和压强的变化如下表所示:
压强/MPa 体积分数/% 温度/℃ | 1.0 | 2.0 | 3.0 |
800 | 54.0 | a | b |
900 | c | 75.0 | d |
1000 | e | f | 83.0 |
①a﹤b ②该反应的熵变△S﹤0 ③900℃、2.0MPa时A的转化率为60%
④K(1000℃)﹥K(800℃) ⑤正反应为吸热反应 上述①~⑤中正确的有( )
A.4个 B.3个 C.2个 D.1个
11.I2可溶于KI溶液并存在下列平衡:I2(aq)+I-(aq)?I3-(aq).测得不同温度下该反应的平衡常数如表.回答下列问题:
(1)上述反应的△H<0(填“>”、“<”或“=”);
(2)上述平衡体系中加入苯,平衡向逆反应方向移动(填“正反应”或“逆反应”);
(3)温度一定,向上述平衡体系中加入少量KI固体,平衡常数不变(填“增大”或“减少”或“不变”).
| t/℃ | 5 | 15 | 25 | 35 | 50 |
| K | 1100 | 841 | 680 | 533 | 409 |
(2)上述平衡体系中加入苯,平衡向逆反应方向移动(填“正反应”或“逆反应”);
(3)温度一定,向上述平衡体系中加入少量KI固体,平衡常数不变(填“增大”或“减少”或“不变”).
18.25℃时,在饱和氯水中存在平衡:Cl2+H2O═H++Cl-+HClO.下列叙述中错误的是( )
| A. | 在饱和氯水中通入H2S气体,溶液的pH变小 | |
| B. | 在饱和氯水中通入SO2气体,溶液的pH变小 | |
| C. | 在饱和氯水中加入CaCO3,平衡向右移,溶液的pH变大 | |
| D. | 在饱和氯水中加入NaOH使pH=7,所得溶液中微粒浓度:c(Na+)>c(ClO-)>c(Cl-)>c(HClO) |
8.在体积为2L的密闭容器中进行下列反应:C(g)+CO2(g)?2CO(g);△H=Q kJ•mol-1.下图为CO2、CO的物质的量随时间t的变化关系图.下列说法不正确的是( )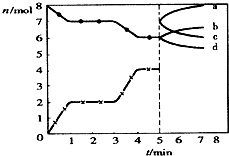

| A. | CO在2-3min和4-5min时平均速率相等 | |
| B. | 当固焦炭的质量不发生变化时,说明反应已达平衡状态 | |
| C. | 5min时再充入一定量的CO,n(CO)、n(CO2)的变化可分别由c、b曲线表示 | |
| D. | 3min时温度由T1升高到T2,重新平衡时K(T2)小于K(T1) |
10.氯酸是一种强酸,浓度超过40%时会发生分解,反应可表示为:a HClO3→b O2↑+c Cl2↑+d HClO4+e H2O,用湿润的淀粉碘化钾试纸检验气体产物时,试纸先变蓝后褪色.下列说法错误的是( )
| A. | 由反应可确定:氧化性HClO3>HClO4 | |
| B. | 变蓝的淀粉碘化钾试纸褪色是因为可能发生了:4C12+I2+6H2O→12H++8Cl-+2IO3- | |
| C. | 若氯酸分解所得的混合气体的平均摩尔质量为47.6g/mol,则反应方程式可表示为:26HClO3→15O2↑+8C12↑+10HClO4+8H2O | |
| D. | 若化学计量数a=8,b=3,则该反应转移电子数为20e |

 极反应:2Cl--2e-=Cl2↑
极反应:2Cl--2e-=Cl2↑