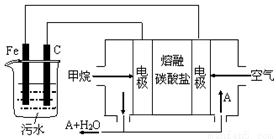
题目内容
20.合金比纯金属的性能更优良,应用范围更广,下列材料不是合金的是( )| A. | 黄铜 | B. | 合金钢 | C. | 硬铝 | D. | 金箔 |
分析 合金是指在一种金属中加热熔合其它金属或非金属而形成的具有金属特性的物质;合金具有以下特点:①一定是混合物;②合金中至少有一种金属等.
解答 解:A.黄铜是铜锌合金,故A正确;
B.钢是铁和碳的合金,故B正确;
C.硬铝是铝合金,故C正确;
D.金箔是纯金,故D错误.
故选D.
点评 本题考查合金的特征,题目难度不大,掌握合金的特征是正确解答本题的关键.

练习册系列答案
 同步练习强化拓展系列答案
同步练习强化拓展系列答案
相关题目
11.I2可溶于KI溶液并存在下列平衡:I2(aq)+I-(aq)?I3-(aq).测得不同温度下该反应的平衡常数如表.回答下列问题:
(1)上述反应的△H<0(填“>”、“<”或“=”);
(2)上述平衡体系中加入苯,平衡向逆反应方向移动(填“正反应”或“逆反应”);
(3)温度一定,向上述平衡体系中加入少量KI固体,平衡常数不变(填“增大”或“减少”或“不变”).
| t/℃ | 5 | 15 | 25 | 35 | 50 |
| K | 1100 | 841 | 680 | 533 | 409 |
(2)上述平衡体系中加入苯,平衡向逆反应方向移动(填“正反应”或“逆反应”);
(3)温度一定,向上述平衡体系中加入少量KI固体,平衡常数不变(填“增大”或“减少”或“不变”).
8.在体积为2L的密闭容器中进行下列反应:C(g)+CO2(g)?2CO(g);△H=Q kJ•mol-1.下图为CO2、CO的物质的量随时间t的变化关系图.下列说法不正确的是( )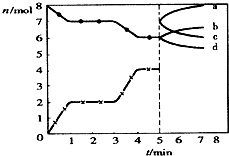

| A. | CO在2-3min和4-5min时平均速率相等 | |
| B. | 当固焦炭的质量不发生变化时,说明反应已达平衡状态 | |
| C. | 5min时再充入一定量的CO,n(CO)、n(CO2)的变化可分别由c、b曲线表示 | |
| D. | 3min时温度由T1升高到T2,重新平衡时K(T2)小于K(T1) |
5.工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁[Fe(OH)SO4]的工艺流程如下:

已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见表:回答下列问题:
(1)加入少量NaHCO3的目的是调节PH,除去溶液中Al3+(使溶液中Al3+生成氢氧化物沉淀),该工艺中“搅拌”的作用是使反应物充分接触,加快反应速率,使反应充分进行.
(2)反应Ⅱ中的离子方程式为Fe2++2H++NO2-=Fe3++NO↑+H2O,在实际生产中,反应Ⅱ常同时通入O2以减少NaNO2的用量,O2的作用是2H2O+4NO+O2=4HNO3.(用化学方程式表示)
(3)生产中碱式硫酸铁溶液蒸发时需要在减压条件下的原因是防止蒸发时温度过高,碱式硫酸铁进一步水解生成Fe(OH)3.
(4)在医药上常用硫酸亚铁与硫酸、硝酸的混合液反应制备碱式硫酸铁.根据我国质量标准,产品中不得含有Fe2+及NO3-.为检验所得产品中是否含有Fe2+,应使用的试剂为
D.(填写字母)
A.氯水 B.KSCN溶液 C.NaOH溶液 D.酸性KMnO4溶液.

已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见表:回答下列问题:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
(2)反应Ⅱ中的离子方程式为Fe2++2H++NO2-=Fe3++NO↑+H2O,在实际生产中,反应Ⅱ常同时通入O2以减少NaNO2的用量,O2的作用是2H2O+4NO+O2=4HNO3.(用化学方程式表示)
(3)生产中碱式硫酸铁溶液蒸发时需要在减压条件下的原因是防止蒸发时温度过高,碱式硫酸铁进一步水解生成Fe(OH)3.
(4)在医药上常用硫酸亚铁与硫酸、硝酸的混合液反应制备碱式硫酸铁.根据我国质量标准,产品中不得含有Fe2+及NO3-.为检验所得产品中是否含有Fe2+,应使用的试剂为
D.(填写字母)
A.氯水 B.KSCN溶液 C.NaOH溶液 D.酸性KMnO4溶液.
6.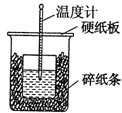 50mL 0.55mol•L-1盐酸与50mL 0.50mol•L-1NaOH溶液在如图的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
50mL 0.55mol•L-1盐酸与50mL 0.50mol•L-1NaOH溶液在如图的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
(1)从实验装置上看,图中尚缺少的一种玻璃仪器是环形玻璃搅拌棒.
(2)从装置图上看除了缺少一种玻璃仪器外,还有一处不妥的是:碎纸条未填满,大小烧杯杯口未相平.
(3)若实验中改用50mL 0.55mol•L-1醋酸溶液进行反应,与上述实验相比,所放出的热量减小(填“减少”“不变”“增多”);
(4)若实验改用25mL 0.55mol•L-1硫酸与25mL 0.50mol•L-1Ba(OH)2溶液代替上述反应,所求得的中和热△H偏小 (填“偏大”“偏小”“无影响”).
(5)已知:Q=cm△t,如果盐酸和NaOH溶液的密度均为1g•cm-3,反应后混合溶液的比热容c=4.18J•(g•℃)-1.实验数据如表:根据上表中所测数据,通过计算得到中和热△H=-56.8kJ/mol(保留一位小数).
(6)下列操作能引起△H偏大的是:①②③(填序号)操作.
①大烧杯上不盖硬纸板
②用环形铜丝搅拌棒搅拌反应混合溶液
③分多次把NaOH溶液倒入装盐酸的小烧杯中.
 50mL 0.55mol•L-1盐酸与50mL 0.50mol•L-1NaOH溶液在如图的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
50mL 0.55mol•L-1盐酸与50mL 0.50mol•L-1NaOH溶液在如图的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:(1)从实验装置上看,图中尚缺少的一种玻璃仪器是环形玻璃搅拌棒.
(2)从装置图上看除了缺少一种玻璃仪器外,还有一处不妥的是:碎纸条未填满,大小烧杯杯口未相平.
(3)若实验中改用50mL 0.55mol•L-1醋酸溶液进行反应,与上述实验相比,所放出的热量减小(填“减少”“不变”“增多”);
(4)若实验改用25mL 0.55mol•L-1硫酸与25mL 0.50mol•L-1Ba(OH)2溶液代替上述反应,所求得的中和热△H偏小 (填“偏大”“偏小”“无影响”).
(5)已知:Q=cm△t,如果盐酸和NaOH溶液的密度均为1g•cm-3,反应后混合溶液的比热容c=4.18J•(g•℃)-1.实验数据如表:根据上表中所测数据,通过计算得到中和热△H=-56.8kJ/mol(保留一位小数).
| 实验 次数 | 起始温度t1/℃ | 终止温度t2/℃] | |
| 盐酸 | NaOH溶液 | ||
| 1 | 20.3 | 20.3 | 23.6 |
| 2 | 20.3 | 20.3 | 23.7 |
| 3 | 20.3 | 20.3 | 25.9 |
| 4 | 20.3 | 20.3 | 23.8 |
①大烧杯上不盖硬纸板
②用环形铜丝搅拌棒搅拌反应混合溶液
③分多次把NaOH溶液倒入装盐酸的小烧杯中.
7.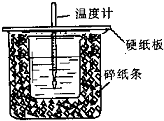 已知中和热的定义为:稀溶液中酸和碱发生中和反应生成1mol水的反应热,某化学兴趣小组要完成中和热的测定实验,装置如右图,回答下列问题:
已知中和热的定义为:稀溶液中酸和碱发生中和反应生成1mol水的反应热,某化学兴趣小组要完成中和热的测定实验,装置如右图,回答下列问题:
(1)从如图实验装置看,其中尚缺少的一种玻璃仪器的名称是
环形玻璃搅拌棒,碎纸条的作用是减少实验过程中的热量损失,如果大烧杯上不盖硬纸板,实验所测得的中和热会偏大(填“偏大”、“偏小”或“无影响”).
(2)实验数据记录如下表(t1为混合前两溶液平均温度,t2为混合充分反应后读取的温度):
①已知反应后溶液的比热容为4.18J•℃-1•g-1,各溶液密度均近似为1g•cm-3,计算完成上表(保留一位小数,将结果填写在表格中横线上)
②强酸与强碱反应的中和热理论值为-57.3kJ•mol-1,下面列举的情况中可能造成上述实验结果与理论值的差距的是ABC(填字母序号)
A.倒入反应溶液时有少许溅出
B.倒入NaOH溶液时速度缓慢
C.未在温度达到最高点时读数
③现用一定量的稀氢氧化钾溶液、澄清石灰水代替氢氧化钠溶液,分别与上述实验的盐酸恰好完全反应时的反应热分别为△H1、△H2,则理论上两者的大小关系为:△H1=△H2(填“<”“>”或“=”)
 已知中和热的定义为:稀溶液中酸和碱发生中和反应生成1mol水的反应热,某化学兴趣小组要完成中和热的测定实验,装置如右图,回答下列问题:
已知中和热的定义为:稀溶液中酸和碱发生中和反应生成1mol水的反应热,某化学兴趣小组要完成中和热的测定实验,装置如右图,回答下列问题:(1)从如图实验装置看,其中尚缺少的一种玻璃仪器的名称是
环形玻璃搅拌棒,碎纸条的作用是减少实验过程中的热量损失,如果大烧杯上不盖硬纸板,实验所测得的中和热会偏大(填“偏大”、“偏小”或“无影响”).
(2)实验数据记录如下表(t1为混合前两溶液平均温度,t2为混合充分反应后读取的温度):
| 实 验 用 品 | 溶液温度(℃) | 中和热△H(kJ•mol-1) | |||
| t1 | t2 | ||||
| ① | 50 mL 0.50 mol•L-1NaOH | 50 mL 0.50 mol•L-1HCl | 20 | 23.3 | -56.8 |
| ② | 50 mL 0.50 mol•L-1NaOH | 50 mL 0.50 mol•L-1HCl | 20 | 23.5 | |
②强酸与强碱反应的中和热理论值为-57.3kJ•mol-1,下面列举的情况中可能造成上述实验结果与理论值的差距的是ABC(填字母序号)
A.倒入反应溶液时有少许溅出
B.倒入NaOH溶液时速度缓慢
C.未在温度达到最高点时读数
③现用一定量的稀氢氧化钾溶液、澄清石灰水代替氢氧化钠溶液,分别与上述实验的盐酸恰好完全反应时的反应热分别为△H1、△H2,则理论上两者的大小关系为:△H1=△H2(填“<”“>”或“=”)