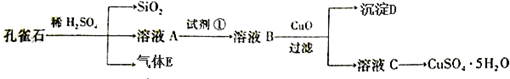
题目内容
18.某NaHCO3和Na2CO3•xH2O的混合物40g,在200℃下,对其加热不再产生气体为止,得到固体21.2g.再把加热过程中产生的气体全部通入含有0.05mol Ca(OH)2的溶液中,恰好使生成的沉淀完全消失,则x为( )| A. | 6 | B. | 7 | C. | 9 | D. | 10 |
分析 加热时NaHCO3和Na2CO3•xH2O发生反应2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O、Na2CO3.xH2O$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+xH2O,加热后得到的固体是Na2CO3,只有NaHCO3生成二氧化碳,二氧化碳和 Ca(OH)2反应方程式为Ca(OH)2+2CO2=Ca(HCO3)2,根据Ca(OH)2+2CO2=Ca(HCO3)2得n(CO2)=2n[Ca(OH)2]=0.05mol×2=0.1mol,
根据2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O 得碳酸氢钠生成的n[Na2CO3]=n(CO2)=0.1mol,最终得到的固体中n(Na2CO3)=$\frac{21.2g}{106g/mol}$=0.2mol,除去碳酸氢钠得到的就是Na2CO3•xH2O得到n(Na2CO3)=0.2mol-0.1mol=0.1mol,
根据2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O得反应前后固体减少的质量=n(H2CO3).M(H2CO3)=n(CO2).M(H2CO3)=0.1mol×62g/mol=6.2g,
则Na2CO3•xH2O反应前后固体减少质量=40g-21.2g-6.2g=12.6g,水的物质的量=$\frac{12.6g}{18g/mol}$=0.7mol,根据Na2CO3•xH2O $\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+xH2O得n(H2O)=xn(Na2CO3)=0.1xmol,从而确定x值.
解答 解:加热时NaHCO3和Na2CO3•xH2O发生反应2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O、Na2CO3.xH2O$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+xH2O,加热后得到的固体是Na2CO3,只有NaHCO3生成二氧化碳,二氧化碳和 Ca(OH)2反应方程式为Ca(OH)2+2CO2=Ca(HCO3)2,根据Ca(OH)2+2CO2=Ca(HCO3)2得n(CO2)=2n[Ca(OH)2]=0.05mol×2=0.1mol,
根据2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O 得碳酸氢钠生成的n[Na2CO3]=n(CO2)=0.1mol,最终得到的固体中n(Na2CO3)=$\frac{21.2g}{106g/mol}$=0.2mol,除去碳酸氢钠得到的就是Na2CO3•xH2O得到n(Na2CO3)=0.2mol-0.1mol=0.1mol,
根据2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O得反应前后固体减少的质量=n(H2CO3).M(H2CO3)=n(CO2).M(H2CO3)=0.1mol×62g/mol=6.2g,
则Na2CO3•xH2O反应前后固体减少质量=40g-21.2g-6.2g=12.6g,水的物质的量=$\frac{12.6g}{18g/mol}$=0.7mol,根据Na2CO3•xH2O $\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+xH2O得n(H2O)=xn(Na2CO3)=0.1xmol,0.1xmol=0.7mol,x=7,
故选B.
点评 本题考查混合物计算、根据反应原理进行计算等,清楚发生反应是解题关键,难度中等.

| t/℃ | 5 | 15 | 25 | 35 | 50 |
| K | 1100 | 841 | 680 | 533 | 409 |
(2)上述平衡体系中加入苯,平衡向逆反应方向移动(填“正反应”或“逆反应”);
(3)温度一定,向上述平衡体系中加入少量KI固体,平衡常数不变(填“增大”或“减少”或“不变”).
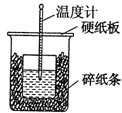 50mL 0.55mol•L-1盐酸与50mL 0.50mol•L-1NaOH溶液在如图的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
50mL 0.55mol•L-1盐酸与50mL 0.50mol•L-1NaOH溶液在如图的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:(1)从实验装置上看,图中尚缺少的一种玻璃仪器是环形玻璃搅拌棒.
(2)从装置图上看除了缺少一种玻璃仪器外,还有一处不妥的是:碎纸条未填满,大小烧杯杯口未相平.
(3)若实验中改用50mL 0.55mol•L-1醋酸溶液进行反应,与上述实验相比,所放出的热量减小(填“减少”“不变”“增多”);
(4)若实验改用25mL 0.55mol•L-1硫酸与25mL 0.50mol•L-1Ba(OH)2溶液代替上述反应,所求得的中和热△H偏小 (填“偏大”“偏小”“无影响”).
(5)已知:Q=cm△t,如果盐酸和NaOH溶液的密度均为1g•cm-3,反应后混合溶液的比热容c=4.18J•(g•℃)-1.实验数据如表:根据上表中所测数据,通过计算得到中和热△H=-56.8kJ/mol(保留一位小数).
| 实验 次数 | 起始温度t1/℃ | 终止温度t2/℃] | |
| 盐酸 | NaOH溶液 | ||
| 1 | 20.3 | 20.3 | 23.6 |
| 2 | 20.3 | 20.3 | 23.7 |
| 3 | 20.3 | 20.3 | 25.9 |
| 4 | 20.3 | 20.3 | 23.8 |
①大烧杯上不盖硬纸板
②用环形铜丝搅拌棒搅拌反应混合溶液
③分多次把NaOH溶液倒入装盐酸的小烧杯中.
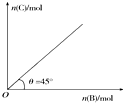 盛有足量A的体积固定的密闭容器中加入B,发生反应:A(s)+2B(g)?4C(g)+D(g)△H<0.一定条件下达到平衡时,C的物质的量与加入的B的物质的量的变化关系如图所示.下列说法不正确的是( )
盛有足量A的体积固定的密闭容器中加入B,发生反应:A(s)+2B(g)?4C(g)+D(g)△H<0.一定条件下达到平衡时,C的物质的量与加入的B的物质的量的变化关系如图所示.下列说法不正确的是( )| A. | 降低温度,则图中θ>45° | |
| B. | 平衡后再加入B,正反应速率增大,逆反应速率减小 | |
| C. | 平衡时B的转化率为50% | |
| D. | 平衡后再加入A,体系内气体密度不变 |
| 选项 | 物质 | 杂质 | 除去杂质所用的试剂和方法 |
| A | 碳酸钠粉末 | 碳酸钙粉末 | 加足量水过滤、蒸发 |
| B | 二氧化碳 | 氧气 | 点燃混合气体 |
| C | 铁 | 氧化铁 | 加足量盐酸蒸发 |
| D | 氯化铁溶液 | 氯化铜 | 加足量铁粉过滤 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 由反应可确定:氧化性HClO3>HClO4 | |
| B. | 变蓝的淀粉碘化钾试纸褪色是因为可能发生了:4C12+I2+6H2O→12H++8Cl-+2IO3- | |
| C. | 若氯酸分解所得的混合气体的平均摩尔质量为47.6g/mol,则反应方程式可表示为:26HClO3→15O2↑+8C12↑+10HClO4+8H2O | |
| D. | 若化学计量数a=8,b=3,则该反应转移电子数为20e |
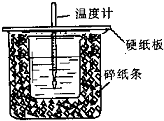 已知中和热的定义为:稀溶液中酸和碱发生中和反应生成1mol水的反应热,某化学兴趣小组要完成中和热的测定实验,装置如右图,回答下列问题:
已知中和热的定义为:稀溶液中酸和碱发生中和反应生成1mol水的反应热,某化学兴趣小组要完成中和热的测定实验,装置如右图,回答下列问题:(1)从如图实验装置看,其中尚缺少的一种玻璃仪器的名称是
环形玻璃搅拌棒,碎纸条的作用是减少实验过程中的热量损失,如果大烧杯上不盖硬纸板,实验所测得的中和热会偏大(填“偏大”、“偏小”或“无影响”).
(2)实验数据记录如下表(t1为混合前两溶液平均温度,t2为混合充分反应后读取的温度):
| 实 验 用 品 | 溶液温度(℃) | 中和热△H(kJ•mol-1) | |||
| t1 | t2 | ||||
| ① | 50 mL 0.50 mol•L-1NaOH | 50 mL 0.50 mol•L-1HCl | 20 | 23.3 | -56.8 |
| ② | 50 mL 0.50 mol•L-1NaOH | 50 mL 0.50 mol•L-1HCl | 20 | 23.5 | |
②强酸与强碱反应的中和热理论值为-57.3kJ•mol-1,下面列举的情况中可能造成上述实验结果与理论值的差距的是ABC(填字母序号)
A.倒入反应溶液时有少许溅出
B.倒入NaOH溶液时速度缓慢
C.未在温度达到最高点时读数
③现用一定量的稀氢氧化钾溶液、澄清石灰水代替氢氧化钠溶液,分别与上述实验的盐酸恰好完全反应时的反应热分别为△H1、△H2,则理论上两者的大小关系为:△H1=△H2(填“<”“>”或“=”)