题目内容
13.萃取碘水中的碘,可用的萃取剂是 ①四氯化碳 ②苯 ③酒精( )| A. | 只有① | B. | ①和② | C. | ①和③ | D. | ①②③ |
分析 萃取剂的选择必须符合下列条件:溶质在萃取剂中的溶解度比在原溶剂中要大;萃取剂与原溶剂不相溶;萃取剂与溶质不反应,以此解答该题.
解答 解:四氯化碳、苯都和水不互溶,且碘在四氯化碳和汽油中的溶解度大于在水中的溶解度,四氯化碳和苯都和碘不反应,所以四氯化碳和苯能作萃取剂萃取碘水中的碘;酒精和水互溶,所以酒精不能作萃取剂.
故选B.
点评 本题考查混合物分离、提纯的方法及应用,为高频考点,侧重于萃取的考查,把握物质的性质、性质差异为解答的关键,注意分离方法的选择,题目难度不大.

练习册系列答案
 灵星计算小达人系列答案
灵星计算小达人系列答案 孟建平错题本系列答案
孟建平错题本系列答案
相关题目
4.1mol SO2和1mol SO3具有相同的:①分子数 ②原子总数 ③硫原子数 ④氧原子数( )
| A. | ①③ | B. | ②④ | C. | ①④ | D. | ①②③ |
1.下列化学反应中,离子方程式表示正确的是( )
| A. | 铜片插入硝酸银溶液中:Cu+Ag+=Cu2++Ag | |
| B. | 铁屑在稀H2SO4作用下产生H2Fe+2H+═Fe2++H2↑ | |
| C. | NaHCO3溶液与NaOH溶液反应H++OH-═H2O | |
| D. | H2SO4溶液与Ba(OH)2溶液混合产生沉淀 SO42-+Ba2+═BaSO4↓ |
8.下列说法中正确的是( )
| A. | 1mol任何气体的体积都约是22.4L | |
| B. | lmolH2和O2的混合气体,在标准状况下的体积约为22.4L | |
| C. | lmol H2气态物质,当体积为22.4L时,该气体一定处于标准状况 | |
| D. | 标准状况下,2molH2O体积约为44.8L |
18.在下列变化过程中,既有离子键被破坏又有共价键被破坏的是( )
| A. | 食盐溶于水 | B. | 碳酸氢钠溶于水 | C. | 将HCl通入水中 | D. | 氯化铵受热分解 |
15.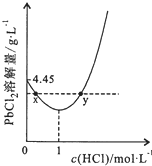 20℃时,PbCl2(s)在不同浓度盐酸中的最大溶解量(单位:g•L-1)如图所示.下列叙述正确的是( )
20℃时,PbCl2(s)在不同浓度盐酸中的最大溶解量(单位:g•L-1)如图所示.下列叙述正确的是( )
 20℃时,PbCl2(s)在不同浓度盐酸中的最大溶解量(单位:g•L-1)如图所示.下列叙述正确的是( )
20℃时,PbCl2(s)在不同浓度盐酸中的最大溶解量(单位:g•L-1)如图所示.下列叙述正确的是( )| A. | 盐酸浓度越大,Ksp(PbCl2)越大 | |
| B. | PbCl2能与一定浓度的盐酸反应 | |
| C. | x、y两点对应的溶液中c(Pb2+)相等 | |
| D. | 往含Pb2+的溶液中加入过量浓盐酸,可将Pb2+完全转化为PbCl2(s) |
16.在1×105Pa和298K时,将1mol气态AB分子分离成气态A原子和B原子所需要的能量称为键能(kJ•mol-1).下面是一些共价键的键能:(已知氨分子中有三个等价的氮氢共价键)
①在1×105Pa、298K时,取一定量的 N2和H2放入一密闭容器中,在催化剂存在下进行反应:N2+H2?NH3,生成2molNH3,该过程中,断键吸收(填“释放”或“吸收”)能量2254KJ,成键释放(填“释放”或“吸收”)能量2346KJ;据此判断工业合成氨的反应是放热反应(填“吸热”或“放热”);
②若将1mol N2和3mol H2放入一密闭容器中在催化剂存在下进行反应,理论上放出或吸收的热量为Q1,而在实际生产中,放出或吸收的热量为Q2,Q1与Q2比较,正确的是A.
A.Q1>Q2 B.Q1<Q2 C.Q1=Q2.
| 共价键 | H-H | N≡N | N-H |
| 键能(kJ•mol-1) | 436 | 945 | 391 |
②若将1mol N2和3mol H2放入一密闭容器中在催化剂存在下进行反应,理论上放出或吸收的热量为Q1,而在实际生产中,放出或吸收的热量为Q2,Q1与Q2比较,正确的是A.
A.Q1>Q2 B.Q1<Q2 C.Q1=Q2.
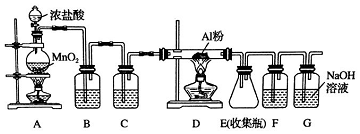
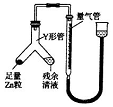
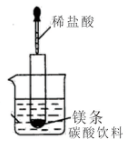 (1)如图所示(夹持仪器省去),把试管放入盛有20℃碳酸饮料的烧杯中,试管中开始放入几块镁条,再用滴管滴加5ml的盐酸于试管中.
(1)如图所示(夹持仪器省去),把试管放入盛有20℃碳酸饮料的烧杯中,试管中开始放入几块镁条,再用滴管滴加5ml的盐酸于试管中.